
Актуальность
Слизистая оболочка дыхательных путей крайне чувствительна к инвазии вредных агентов: даже в покое за сутки в легкие поступает около 9 тыс. литров воздуха, который содержит всевозможные органические и неорганические примеси, в том числе вирусы и бактерии. В связи с этим адекватная работа защитных механизмов дыхательных путей является залогом эффективной работы всей бронхолегочной системы. Одним из важных механизмов защиты является мукоцилиарный клиренс (МЦК), обеспечивающий удаление поступающих извне инородных частиц и инфектов [1].
При различных воспалительных заболеваниях нижних дыхательных путей в связи с изменениями состава и реологических свойств бронхиального секрета (мокроты), повреждением эпителия слизистой возникает дисфункция МЦК.
В начале заболевания слизистая оболочка бронхов реагирует на патогенное воздействие развитием местного воспаления, сопровождаемого повышением активности серозных подслизистых желез, в результате чего увеличивается продукция мокроты. При бактериальных инфекциях бронхиальный секрет быстро трансформируется из слизистого в слизисто–гнойный с высоким содержанием муцинов, благодаря которым наблюдается увеличение вязкости мокроты. Повышенные вязкость и адгезия затрудняют движение ресничек мерцательного эпителия, блокируя МЦК: продвижение секрета замедлятся или прекращается, что способствует колонизации микроорганизмами, пролонгации воспалительного процесса, развитию бронхиальной обструкции, вентиляционно–перфузионных нарушений и оксидативного стресса [2]. Избыток бронхиального секрета также приводит к снижению функции местного иммунитета (подавляется синтез sIgA) и препятствует проникновению лекарственных аэрозолей к рецепторному аппарату слизистой оболочки дыхательных путей, снижая их терапевтическую эффективность.
Таким образом, итогом любого ирритативного, инфекционного либо аллергического воспаления слизистой оболочки бронхов является изменение количества и реологических свойств мокроты, нарушение дренажной функции бронхов [3].
Затрудненное откашливание мокроты – частая жалоба при многих заболеваниях дыхательных путей. С учетом этого многие схемы лечения включают в себя бронхосекретолитические (муколитические) препараты. Одним из наиболее часто используемых препаратов является Лазолван® (амброксол).
По данным литературы, известно о противовоспалительном и иммуномодулирующем действии Лазолвана® (амброксола). Препарат усиливает местный иммунитет, активируя тканевые макрофаги и повышая продукцию секреторного IgA [4].
Противовоспалительное действие амброксола обусловлено ингибированием хемотаксиса нейтрофилов, продукции мононуклеарными клетками интерлейкина–1 (IL–1), фактора некроза опухоли–α (TNF–α), гистамина и серотонина, а также противоотечным и антиоксидантным действием [2,5].
Наиболее актуальными вопросами в практике педиатра являются вопросы о сроках, длительности и объеме муколитической терапии. Экспертная оценка историй развития ребенка (форма 112) говорит о целесообразности назначения данной группы препаратов только в острый период заболевания, в период остаточных явлений, как правило, муколитическая терапия прекращается.
Цель: Исследовать динамику воспалительного потенциала слизистой оболочки бронхов у детей после перенесенного острого бронхита на фоне приема Лазолвана® (амброксола) по данным цито–иммунологических показателей индуцированной мокроты.
Материалы и методы
В исследование были включены дети, находящиеся на обследовании и лечении в отделении патологии раннего возраста МУЗ ГКБ № 1 города Челябинска.
Критерии включения в исследование:
1. Возраст от 1 года до 5 лет.
2. Острый бронхит, перенесенный за 14–21 день до начала исследования.
3. Согласие родителей на участие в исследовании.
Согласно критериям включения/исключения, в исследование был включен 31 ребенок.
В ходе исследования дети были распределены на 2 группы:
– 1 группа (n=21) получала Лазолван® раствор в виде ингаляций через небулайзер в дозе 30 мг/сут (2 ингаляции);
– 2 группа (n=10) получала ингаляции с 0,9%–м раствором хлорида натрия 2 раза в сутки.
Средний возраст обследованных детей (Ме) составил 3 года. Дети были обследованы в первый день (до начала приема препарата), а затем в динамике через 7 и 14 дней лечения.
Индукция мокроты проводилась по модифицированному нами протоколу с использованием гипертонического раствора хлорида натрия (патент РФ № 2364341).
В индуцированной мокроте (ИМ) определялся цитологический состав и иммунологические показатели: количество белка, муцина, sIgА, IL–1β, IL–8, TNF–α, метаболиты оксида азота (NO). При определении иммунологических показателей ИМ использовались аппаратные методы учета результатов, достаточно специфичные и чувствительные для выявления минимальных количеств иммунных белков в биологических жидкостях.
Результаты и обсуждение
При взаимодействии патоген–хозяин происходит комплекс событий, направленных на элиминацию микроорганизма [6]. Фагоциты формируют первую линию защиты, их основной задачей является быстрое реагирование на повреждающий фактор и его уничтожение. К фагоцитам относят нейтрофилы и макрофаги – важнейшие эффекторные клетки врожденной иммунной системы [7–9]. Активность фагоцитирующих мононуклеаров проявляется не только во внутриклеточном переваривании и уничтожении микроорганизма, но и в инициации секреции набора цитокинов с различной функциональной активностью.
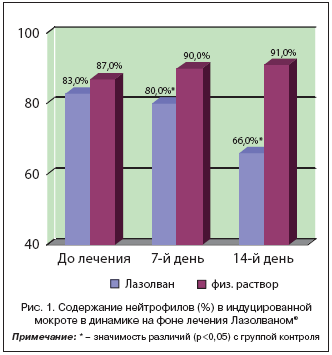
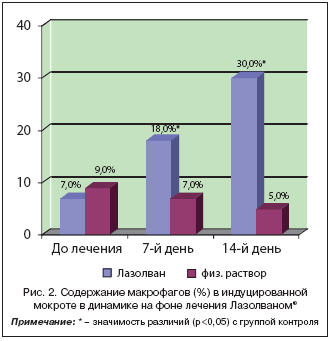
Процентный состав клеточных элементов в мокроте в динамике на фоне лечения отражен на графиках (рис. 1 и 2).
При исследовании цитологического состава мокроты у здоровых лиц большинство авторов отмечают невысокий цитоз, высокое содержание макрофагов (58,8–92,1%), нейтрофилов (3,4–37,5%) и низкое – лимфоцитов (1–2,2%) и эозинофилов (не более 1%). У обследованных детей, перенесших острый бронхит, выявлено значительно более высокое содержание нейтрофилов; достоверное снижение их содержания выявлено уже через 7 дней в группе 1 (получающих Лазолван®), в группе 2 – не изменилось за все время исследования. Содержание макрофагов также изменилось только в группе 1 – к 14–му дню лечения увеличилось более чем в 4 раза, но все же было в 2 раза ниже, чем должно быть у здоровых детей.
Все разнообразие биологического действия цитокинов, секретируемых макрофагами, направлено на нейтрализацию и уничтожение патогена. Этот процесс начинается с инициации белков острой фазы и активации системы комплемента, что приводит к привлечению в зону проникновения чужеродного агента фагоцитирующих клеток и продукции цитокинов – интерлейкина–1, интерлейкина–8, а также фактора некроза опухоли–альфа (TNF–α), обладающих местными и системными эффектами. Основная задача TNF–α состоит в формировании очага воспаления. Под его влиянием увеличивается диаметр сосудов в очаге инфекции, концентрация иммуноглобулинов, комплемента и других функционально значимых белков в очаге проникновения инфекции. Под влиянием TNF–α также происходит экспрессия адгезивных молекул на эндотелиальных клетках, в результате чего усиливается приток фагоцитов в очаг воспаления, что крайне важно для локализации инфекции. Проникшие через эндотелиальную стенку фагоциты мигрируют непосредственно в очаг воспаления, перемещаясь по градиенту плотности, создаваемому IL–8.
В нашем исследовании по содержанию цитокинов в индуцированной мокроте получены следующие результаты:
– уровень TNF–α в группе, получающих амброксол, снизился в 2 раза через 7 дней (р<0,05) и в 4 раза через 14 дней лечения (р<0,05), в то время как в группе сравнения практически не изменился (рис. 3).
Содержание IL–8 в индуцированной мокроте (рис. 4) также достоверно уменьшилось через 14 дней только на фоне терапии амброксолом (р<0,05).
IL–1β – медиатор острого и хронического воспаления, осуществляет различные функции: индуцирует хемотаксис полиморфноядерных лейкоцитов, хемотаксис макрофагов. Среди набора веществ, вызывающих продукцию IL–1, наиболее активны компоненты клеточной стенки бактерий и цитокины, появляющиеся в очаге воспаления в ходе развития защитной реакции.
В обеих группах уровень IL–1β к 14–му дню исследования уменьшился в 1,5 раза, что свидетельствует о снижении провоспалительного потенциала на уровне слизистой оболочки бронхов у обследованных детей.
Среди иммуноглобулинов основным является sIgA, интенсивность его синтеза находится в прямой зависимости от состояния клеток слизистой оболочки бронхов и нарушается при ее воспалительных изменениях [2].
На 14–й день исследования содержание sIgA выросло в 2 раза в обеих группах, достоверно не отличаясь между ними (рис. 5), что, по–видимому, отражает естественные процессы репарации слизистой оболочки бронхов после перенесенного инфекционного заболевания независимо от проводимой терапии.
Оксид азота – мощный вазодилататор, синтезируемый в основном в клетках бронхиального эпителия и отражающий выраженность воспаления дыхательных путей [10]. В нашем исследовании содержание NO оставалось высоким в обеих группах и через 14 дней лечения.
Следует отметить, что в нашем исследовании не было выявлено достоверной разницы по содержанию муцина в мокроте между группами детей, получавших амброксол и ингаляции 0,9%–го раствора хлорида натрия.
Заключение
У детей, перенесших острый бронхит, спустя 2–3 недели обнаруживаются изменения клеточного и цитокинового состава индуцированной мокроты.
К 14–му дню исследования в группе детей, получающих ингаляции Лазолвана®, произошло изменение соотношения клеточных элементов индуцированной мокроты в сторону увеличения альвеолярных макрофагов и уменьшения нейтрофилов. Тем не менее количество нейтрофилов оставалось достаточно высоким (в 2 раза выше, чем у здоровых).
На фоне лечения амброксолом к 14–му дню значительно уменьшилось содержание провоспалительных цитокинов – TNF–α и IL–8.
В то же время увеличение содержания sIgА и уменьшение IL–1β произошло в обеих группах (получавших амброксол и физ. раствор), что отражает естественные процессы репарации слизистой оболочки бронхов после перенесенного инфекционного заболевания.
Следует отметить, что в нашем исследовании не было выявлено достоверных отличий по содержанию NO и муцина в индуцированной мокроте между группами детей, получавших амброксол и ингаляции 0,9%–го раствора хлорида натрия. Вероятно, эти показатели имеют бо́льшее значение в острый период заболевания или процесс репарации занимает бо́льший промежуток времени, чем период нашего наблюдения.
Таким образом, терапия Лазолваном®, назначаемая детям, перенесшим острый бронхит, приводит к улучшению ряда показателей, отражающих выраженность воспаления (увеличение содержания альвеолярных макрофагов и уменьшение нейтрофилов, снижение уровней TNF–α и IL–8 в индуцированной мокроте).



Литература
1. Научно–практическая программа «Острые респираторные заболевания у детей. Лечение и профилактика». – М., 2002. – 70 с.
2. Амелина, Е.Л. Мукоактивная терапия / Е.Л. Амелина, Э.Х. Анаев, С.А. Красовский и др. / под ред. А.Г. Чучалина, А.С. Белевского. – М.: Атмосфера, 2006. – 128 с.
3. Мизерницкий, Ю.Л. Значение экологических факторов при бронхиальной астме у детей / Ю.Л. Мизерницкий // Пульмонология. – 2002. – № 1. – С. 56–62.
4. Княжеская, Н.П. Обоснование выбора препарата для лечения кашлевого синдрома и заболеваний, сопровождающихся выделением мокроты / Н.П. Княжеская, А.Г. Чучалин // Русский медицинский журнал. – 2007. – Т. 15, № 18. – С. 1–4.
5. Геппе Н.А. Кашель у детей. Вопросы и ответы / Н.А. Геппе, М.Н. Снегоцкая // пособие для врачей. – М., ММА им. И.М.Сеченова. – 18 с.
6. Nau G., Richmond J., Schbesinger A. et al. Human macropage activation programs induced by bacterial pathogens // Proc. Natl. Acad. Sci. USA. – 2002. – Vol. 99, № 3. – Р. 1503–1508.
7. Пащенков М., Пинегин Б. Основные свойства дендритных клеток // Иммунология. – 2001. – № 4. – С. 7–16.
8. Fitzpatrick, A.M. Alveolar macrophage phagocytosis is impaired in children with poorly controlled asthma / A.M. Fitzpatrick, F. Holguin, W.G. Teague, L.A. S. Brown // J. Allergy Clin Immunol. – 2008. – Vol. 121, № 6. – P. 1372–1378.
9. St–Laurent, J. Alveolar macrophage subpopulations in bronchoalveolar lavage and induced sputum of asthmatic and control subjects / J. St–Laurent, V. Turmel, L.P. Boulet, E. Bissonnette // J. Asthma. – 2009. – Vol. 46, № 61. – P. 1–8.
10. Ricciardolo, F.L. Nitric oxide in health and disease of the respiratory system / F.L.M. Ricciardolo, P.J. Sterk, B. Gaston et al. // Physiol. Rev. – 2004. – Vol. 84, № 3. – Р. 731–765.
Жаков Я.И., Минина Е.Е., Бабайлов М.С.
РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: