
Основными механизмами резистентности микроорганизмов являются продукция ферментов, которые инактивируют антибиотики; нарушение или изменение структуры рецепторов, с которыми необходимо связаться антибиотикам для подавления бактериального роста; снижение концентрации антибиотиков внутри бактерий, связанное с невозможностью их попадания внутрь бактериальных клеток из–за нарушения проницаемости внешней оболочки или активного выведения с помощью специальных насосов.
Резистентность к антибиотикам наблюдается повсеместно и имеет неблагоприятную тенденцию к повышению. К настоящему времени, кроме резистентности к определенному или группе препаратов, выделяют полирезистентные бактерии, т.е. резистентные к основным группам антибактериальных препаратов (b–лактамам, аминогликозидам, фторхинолонам) и панрезистентные, в отношении которых, согласно данным микробиологических исследований, не имеется активных антибиотиков.
История создания антибактериальных препаратов была непосредственно связана с решением определенных клинических задач: поиском препаратов с высокой природной активностью для подавления стрептококков (пенициллин, ампициллин), стафилококков (оксациллин), грамотрицательной флоры (аминогликозиды); преодолением побочных эффектов (аллергия к природным пенициллинам); повышения пенетрации антибиотиков в ткани и клетки (макролиды, фторхинолоны). Однако применение антибиотиков привело к активации процессов защиты микрофлоры от них. Поэтому при разработке препаратов, которые в настоящее время широко применяются в клинике, стала актуальной задача преодоления природной и приобретенной резистентности нозокомиальной флоры. Наиболее яркими представителями этой, относительно новой генерации препаратов являются карбапенемы.
Разработка карбапенемов
и их структурно–функциональные
особенности
Подобно пенициллинам и цефалоспоринам карбапенемы имеют природный источник. Первый карбапенем – тиенамицин является продуктом Streptomyces cattleya. Основной структурой тиенамицина и последующих карбапенемов, подобно пенициллинам, являются пятичленное b–лактамное кольцо. Химической особенностью карбапенемов, отличающей их от пенициллинов, является замена углерода азотом в 1 позиции и наличие двойных связей между 2 и 3 атомами углерода, высокая устойчивость к гидролизу b–лактамного кольца в 6-й позиции и наличие тиогруппы во 2-й позиции пятичленного кольца. Считается, что последнее из перечисленных отличий связано с повышенной антисинегнойной активностью карбапенемов.
Первый из карбапенемов – имипенем появился в клинической практике в 1986 году. Для повышения стабильности этого препарата против почечной дигидропептидазы–1 имипенем стали комбинировать с ингибитором этого фермента – циластатином, что существенно улучшило его фармакокинетику в почках.
Меропенем появился в клинической практике в 1996 году. Основным химическим отличием от имипенема было наличие транс–гидроксиэтильной группы в 6-м положении, которая определяла стабильность препарата к действию различных b–лактамаз, уникальность микробиологических и фармакологических характеристик. Появление боковой диметилкарбамилпирролидинтиогруппы во 2-м положении пятичленного кольца резко повысило активность препарата против Pseudomonas aeruginosa и других важнейших грамотрицательных бактерий. Метильная группа в 1 позиции создала стабильность препарата к действию почечной дигидропептидазы–1, что позволило использовать препарат без циластатина.
Эртапенем стал третьим препаратом в линейке карбапенемов в 2001 году. Подобно меропенему, он стабилен к почечной дигидропептидазе–1 и различным b–лактамазам. Химическим отличием этого препарата стало замещение метильной группы остатком бензойной кислоты во 2 позиции пятичленного кольца, что резко повысило его связывание с белками плазмы. Этот показатель достигает 95%, у имипенема – 20% и 2% – у меропенема. В результате этого увеличился период полувыведения препарата из плазмы, появилась возможность его введения 1 раз в сутки. Модификация химической структуры оказала негативное влияние на его активность в отношении неферментирующих грамотрицательных бактерий, таких как Pseudomonas aeruginosa и Acinetobacter baumannii [4–6]. В отношении Psedomonas aeruginosa предполагается, что существенное изменение заряда, увеличение молекулярного веса и липофильности нарушило пенетрацию эртапенема через мембранный пориновый канал (OprD), который является важнейшим порталом для пенетрации карбапенемов [7, 8].
В 2010 году появился новый карбапенем – дорипенем. Его химическая структура напоминает меропенем и эртапенем, отличается наличием сульфаммонил–аминометил–пирролидин–тиогруппы во 2-й позиции пятичленного кольца. Это изменение привело к повышению активности против Staphylococcus aureus, при этом активность против грамположительной флоры существенно не изменилась по сравнению с меропенемом [4–6, 9].
Механизм действия и значение
пенициллинсвязывающих белков
Карбапенемы, как и другие b–лактамные антибиотики, являются бактерицидными ингибиторами синтеза клеточной стенки благодаря их связыванию с пенициллинсвязывающими белками (ПСБ). ПСБ – это цитоплазматические белки клеточной стенки, завершающие синтез пептидогликана – скелета клеточной стенки. Карбапенемы связываются со всеми основными ПСБ грамотрицательных бактерий. Основным отличием связывания с ПСБ карбапенемов и других b–лактамов является высокая аффинность к ПСБ–1а и 1b Pseudomonas aeruginosa и E. coli, что приводит к быстрому киллингу бактерий, увеличивает количество погибших бактерий. Среди карбапенемов, в свою очередь, имеются различия в аффинности к ПСБ–2 и –3 грамотрицательных бактерий. Имипенем имеет большее сродство к ПСБ–2 по сравнению с ПСБ–3. Это приводит к тому, что до возникновения лизиса бактерии приобретают сферическую или эллипсовидную форму. Однако, аффинность к ПСБ–2 и –3 Pseudomonas aeruginosa – одинаковая. Аффинность меропенема и эртапенема к ПСБ–2 и –3 E. coli значительно выше, чем у имипенема. Точно также аффинность к ПСБ–2 Pseudomonas aeruginosa у меропенема выше, чем у имипенема, однако в отношении ПСБ–3 – она выше в 3–10 раз. Аффинность к ПСБ–2–3 у меропенема и дорипенема – одинаковая [10,11]. При этом имеются индивидуальные различия микробных штаммов в аффинности ПСБ к различным карбапенемам.
Фармакодинамические
особенности карбапенемов
В большей степени зависят от кратности введения препаратов, чем от концентрации в крови, что отличает их от аминогликозидов и фторхинолонов, эффективность которых напрямую связана с концентрацией препарата в плазме. Максимальный бактерицидный эффект карбапенемов наблюдается при достижении концентрации в плазме, превышающей минимальную подавляющую концентрацию (МПК) в 4 раза [12]. В отличие от карбапенемов эффективность аминогликозидов и фторхинолонов возрастает пропорционально их концентрации в плазме и может быть ограничена только максимально разрешенной разовой дозой препарата [13].
Важнейшим фармакодинамическим показателем карбапенемов является отношение времени, когда концентрация препарата превышает МПК, ко времени между введениями препарата, этот показатель выражается в процентах (T>МПК%). Теоретически идеально было бы поддерживать концентрацию карбапенема все 100% интервала между введениями препарата. Однако это не обязательно для достижения оптимального клинического результата [14–16]. Более того, этот интервал является разным у различных b–лактамных антибиотиков. Для достижения бактериостатического эффекта антибиотика необходимо достижение показателя на уровне 30–40% для пенициллинов и цефалоспоринов и 20% – для карбапенемов. Для достижения максимального бактерицидного эффекта необходимо достижение показателя 60–70% для цефалоспоринов, 50% – для пенициллинов и 40% – для карбапенемов [13,17]. Несмотря на то, что пенициллины, цефалоспорины и карбапенемы убивают бактерии с помощью одного механизма, различия в показателях T>МПК отражают различия в быстроте киллинга, который наименее быстрый у цефалоспоринов и наиболее быстрый – у карбапенемов [13]. Молекулярными причинами различия этого процесса у цефалоспоринов и карбапенемов может быть различная аффинность этих препаратов к ПСБ–1а
и –1b.
Другой важной характеристикой этих препаратов является продолжительность постантибиотического эффекта (ПАЭ). ПАЭ – это эффект препарата, который продолжается после его удаления из системы. Среди β–лактамов ПАЭ наиболее часто наблюдается у карбапенемов. ПАЭ имипенема против некоторых микробов, включая P. aeruginosa, продолжается 1–4,6 часа [18–21]. Необходимо отметить, что этот показатель может существенно варьировать среди штаммов, принадлежащих к одному роду. У меропенема ПАЭ подобен имипенему [22]. Продолжительность ПАЭ эртапенема в отношении грамположительных бактерий составляет 1,4–2,6 часов. У дорипенема ПАЭ против S. aureus, K. pneumoniae, E. coli и P. aeruginosa наблюдался около 2 часов, причем только в отношении штаммов S. aureus и P. aeruginosa [23].
Спектр активности
и клиническая эффективность
Карбапенемы имеют наиболее широкий спектр активности среди всех антибактериальных препаратов. Они активны против грамположительных и грамотрицательных микробов, включая аэробов и анаэробов. Показатель МПК50 позволяет оценить их природную активность и резистентность, по этому показателю они сходны с фторхинолонами и аминогликозидами. У некоторых бактерий отсутствует природная чувствительность к карбапенемам, например, у S. maltophila, B.`cepacia, E. faecium и резистентных к метициллину стафилококков [4,5,9,24–26]. Имеются определенные различия между карбапенемами по природной активности, что может быть связано с нарушением пенетрации препаратов через клеточную мембрану и активности эффлюксных насосов. Данные по сравнительной активности всех 4 препаратов в отношении одних и тех же клинических штаммов микробов очень ограничены. Однако имеются экспериментальные данные глобальных сравнительных исследований активности этих препаратов, которые также не являются исчерпывающими [4,6]. Например, в одном из них нет сравнительной оценки определенных значений МПК: минимальная концентрация для дорипенема и меропенема составила 0,008 мкг/мл, для эртапенема – 0,06 мкг/мл, а для имипенема – 0,5 мкг/мл, поэтому у 3023 штаммов E. coli сравнение МПК90 оказалось возможным только при указанных выше показателях. Тем не менее имеются данные прямого сравнения МПК дорипенема, меропенема и имипенема в отношении энтеробактерий, P. aeruginosa, Haemophylus influenza и Bordetella pertussis, которые указывают на их сходную природную активность по показателю МПК50, который был аналогичным или отличался на одно– двукратное разведение [27,28]. Только в отношении Proteus mirabilis активность меропенема была в 4 раза выше, чем активность дорипенема, и оба препарата оказались достоверно активнее имипенема, эти же тенденции сохранились и в отношении МПК90. Все три препарата оказались одинаково активными против чувствительных и резистентных к пенициллину S. pneumoniae. Резистентность, связанная с модификацией пенициллинсвязывающих белков, оказывала достоверное влияние на активность карбапенемов: МПК50 и МПК90 резистентных к пенициллину штаммов оказались в 32–64 раза выше, чем у чувствительных, при этом МПК90 оставалась ниже 1 мкг/мл. Дорипенем имел сходную с имипенемом активность против S. aureus и E. faecalis, Против чувствительных к цефтазидиму энтеробактерий, которые не продуцировали b–лактамаз расширенного спектра (БЛРС) активность эртапенема, меропенема и дорипенема была равной и превосходила таковую имипенема. Однако активность эртапенема была существенно ниже против неферементирующей грамотрицательной флоры (P. aeruginosa, A. baumannii) [4–6]. В отношении S. pneumoniae, S. aureus, S. epidermidis и E. faecalis активность карбапенемов была примерно одинаковой, включая эртапенем. В отношении грамположительных и грамотрицательных анаэробов активность карбапенемов также были одинаковой с МПК50 1 мкг/мл и ниже.
Карбапенемы
и механизмы резистентности
Резистентность к b–лактамам имеется у грамотрицательных и грамположительных микроорганизмов. У грамположительных бактерий не имеется механизмов резистентности, связанных с изменением свойств внешней мембраны, или ферментов, способных разрушать карбапенемы. Появление резистентности грамположительных бактерий связано с изменением пенициллинсвязывающих белков (ПСБ), например, появлением ПСБ–2а с низкой аффинностью ко всем b–лактамам у резистентных к метициллину S. aureus (MRSA). У грамотрицательных бактерий наличие внешней мембраны и различных b–лактамаз приводило к появлению резистентности, связанной с продукцией инактивирующих ферментов (b–лактамаз), нарушением структуры ПСБ, снижением накопления препарата в перипластическом пространстве из–за снижения проницаемости белков–поринов внешней мембраны или эффлюксных насосов, выводящих различные антибиотики из микробной клетки. Из них наибольшее значение имеет продукция b–лактамаз и снижение клеточной проницаемости.
Бета–лактамазы расширенного
спектра и класса AmpC
Продукция ββ–лактамаз является наиболее частым механизмом резистентности грамотрицательных бактерий. Расположение гидроэтилгруппы в положении 6 определяет высокую стабильность карбапенемов по сравнению с цефалоспоринами и пенициллинами к гидролизу ββ–лактамазами [29,30], в особенности цефалоспориназами (БЛРС и AmpC). Поэтому реальным отличием карбапенемов от других b–лактамных антибиотиков является именно стабильность к действию БЛРС и AmpC.
AmpC – цефалоспориназы с широким спектром активности, разрушающие пенициллины (в том числе защищенные) и большинство цефалоспоринов. Необходимым условием разрушения антибиотиков является высокий уровень продукции этого фермента микробом. У P. aeruginosa и многих энтеробактерий (E. coli, K. pneumoniae) в хромосомах содержится информация о синтезе AmpC, однако синтез начинается при определенных условиях – при контакте с антибиотиком. Такой характер образования и выделения фермента называется индуцибельным. Однако при наличии врожденной предрасположенности к гиперпродукции фермента в результате мутации может происходить его депрессия [31]. Цефалоспориназы AmpC имеются на плазмидах некоторых энтеробактерий, наиболее часто они встречаются у K. pneumoniae и E. coli [32–34]. Некоторые передающиеся плазмидами AmpC могут иметь индуцибельный фенотип. Вне зависимости от того, является ли AmpC хромосомной или плазмидной, ее гиперпродукция у энтеробактерий и P. aeruginosa приводит к резистентности почти ко всем ββ–лактамам. Тем не менее многие энтеробактерии – гиперпродуценты AmpC остаются чувствительными к цефепиму и карбапенемам, а большинство P. aeruginosa–гиперпродуцентов AmpC оказываются чувствительными к имипенему, меропенему и дорипенему.
Продукция БЛРС является вторым механизмом резистентности к ββ–лактамам. Продукция этих ферментов приводит к резистентности к пенициллинам и цефалоспоринам [25,36]. Источником этих ферментов для энтеробактерий оказалась Kluyvera spp. [37]. Необходимо отметить, что этот тип ββ–лактамаз может быть подавлен ингибиторами ββ–лактамаз (сульбактам, тазобактам, клавулановая кислота), поэтому защищенные пенициллины и цефалоспорины могут сохранять свою активность в отношении продуцентов БЛРС. Однако карбапенемы считаются препаратами выбора для лечения инфекций, вызванных энтеробактериями – продуцентами БЛРС [38]. Показано, что E. coli и K. pneumoniae остаются чувствительными ко всем карбапенемам, за исключением эртапенема, и МПК90 достоверно не изменяется. МПК90 эртапенема у продуцентов БЛРС оказывается, примерно, в 4 раза выше, чем у «диких» штаммов [39].
Карбапенемазы
Кроме БЛРС и AmpC, некоторые бактерии имеют ферменты (карбапенемазы), информация о которых кодирована на хромосоме или плазмидах [40]. Такие ферменты способны продуцировать некоторые энтеробактерии, P. aeruginosa и Acinetobacter spp. Карбапенемазы представляют сложную проблему для лечения тяжелых инфекций карбапенемами, однако прямой корреляции между продукцией карбапенемаз и резистентностью к карбапенемам выявить не удалось. Одним из объяснений этого факта является различие гидролитической активности карбапенемаз в отношении различных субстратов, каковыми являются различные препараты карбапенемов [41]. Другими причинами могут быть одновременное снижение пенетрации через бактериальную стенку (изменение структуры пориновых белков) или недоступность целевых пенициллинсвязывающих белков (наличие карбапенемаз в перипластическом пространстве). При наличии продукции карбапенемаз, в клинических ситуациях не следует применять карбапенемы для лечения инфекций, вызванных такими микробами.
Резистентность,
связанная с поринами
Снижение пенетрации внутрь бактериальной клетки является одним из механизмов резистентности к карбапенемам у энтеробактерий [41–45/58]. Наиболее хорошо изучена резистентность P. aeruginosa, связанная с изменением структуры порина OprD, который осуществляет пассивный захват основных аминокислот и коротких пептидов, но также служит каналом для карбапенемов [46,47]. Именно этот механизм резистентности характерен для карбапенемов и не влияет на чувствительность к другим ββ–лактамным АБ. У P. aeruginosa этот механизм связан с рядом генетических механизмов и приводит к повышению МПК имипенема в 4–16 раз, меропенема – в 4–32 раза, дорипенема – в 8–32 раза [48–51]. Несмотря на кажущееся преимущество имипенема, его МПК становится выше уровня, который рассматривается как чувствительный (4 мкг/мл), а МПК дорипенема и меропенема остаются ниже 4 мкг/мл [52].
Резистентность P. aeruginosa,
связанная с эффлюксом
У потенциально резистентных P. aeruginosa в хромосоме имеются гены, кодирующие информацию о нескольких эффлюксных насосах, выводящих из клетки различные антибиотики. Наиболее изученными являются Mex–OprM, MexCD–OprJ, MexEF–OprN и MexXY. Эти насосы способны выкачивать из цитоплазмы и перипластического пространства клетки различные препараты. В результате изучения этих насосов открылись перспективы разработки новых антибактериальных препаратов, способных контролировать процесс их работы. Исходя из этого стала понятной необходимость отдельного рассмотрения их роли в резистентности к имипенему, меропенему и дорипенему у P. aeruginosa.
Точно не установлены насосы, выводящие имипенем. Однако показано, что при высокой экспрессии двух эффлюксных насосов (MexCD–OprJ и MexEF–OprN) происходит значительное снижение чувствительности P. aeruginosa к имипенему. Показано, что этот механизм не связан с комбинацией ββ–лактамазной активности AmpC и OprD [53]. В то же время высокая экспрессия MexCD–OprJ и MexEF–OprN приводит к достоверному снижению чувствительности к имипенему за счет снижения экспрессии OprD [50,54,55].
В отличие от имипенема меропенем является подходящим субстратом для эффлюксных насосов: показано, что он выводится из клеток с помощью MexAB–OprM, MexCD–OprJ и MexEF–OprN [57]. По данным других исследований, только гиперпродукция MexAB–OprM определяет резистентность к меропенему [8]. Влиянием этого механизма объясняется различие в резистентности к имипенему и меропенему штаммов P. aeruginosa, имеющих такие насосы. Важно отметить, что повышенная продукция MexAB–OprM не обязательно приводит к подъему МПК выше уровня чувствительности [56], однако свидетельствует о вероятном взаимодействии этого механизма с другими (например, резистентности связанной с OprD) и поэтому имеет важное клиническое значение. В отношении дорипенема показано, что он является субстратом для MexAB–OprM, MexCD–OprJ и MexEF–OprN эффлюксных насосов, более подробных сведений в литературе нет [57]. Таким образом, взаимодействие механизмов, связанных с выведением, нарушением проницаемости, ββ–лактамазной активности и доступности ПСБ приводит к клинически значимой резистентности к карбапенемам.
Дозирование и клиническая
фармакокинетика
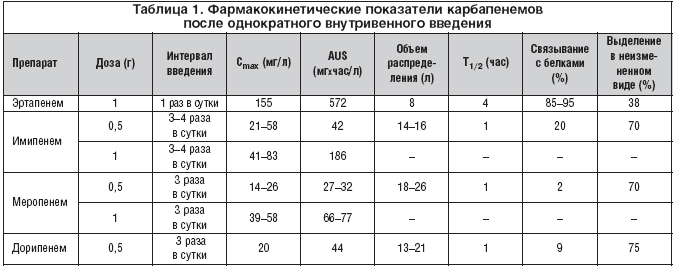
Все карбапенемы являются водорастворимыми веществами и вводятся внутривенно или внутримышечно из–за низкого всасывания из желудочно–кишечного тракта. Основные дозировки препаратов представлены в таблице 1.
Величина связывания с белками является важным показателем фармакокинетики и антибактериальной активности препаратов. Фармакодинамический анализ антибактериальных препаратов требует учета связывания с белками и обсуждения кинетики именно «свободного» препарата. Как показано в таблице, связывание с белками имипенема (20%), дорипенема (8%) и меропенема (3%) существенно различаются [57,58]. Изменение структуры эртапенема существенно повысило дозозависимое связывание с белками: до 95% при концентрации в плазме ниже 100 мг/л и 85% – выше 300 мг/л. Высокая связь с белками приводит к более продолжительному выведению: период полувыведения эртапенема составляет 4 часа, по сравнению с 1 часом для других карбапенемов. Фармакокинетический профиль «свободного» препарата после введения дозы 500 мг показывает его эквиваалентность у имипенема, меропенема и эртапенема. При этом преимущественно почечный клиренс препарата наблюдается у имипенема, меропенема и дорипенема.
Из–за продолжительного периода полувыведения эртапенем является единственным карбапенемом, который вводится 1 раз в сутки (500 мг или 1 г) [58]. Меропенем вводится по 500 мг или 1 г через 8 часов, а имипенем по 500 мг или 1 г через 6–8 часов. Снижение почечного клиренса требует снижения дозировки препаратов, однако при применении эртапенема этот клиренс должен быть ниже 30 мл/мин, при применении меропенема – ниже 51 мл/мин. Судорожный потенциал имипенема требует особого внимания при выборе дозировки препарата с учетов функции почек и массы тела. Снижение дозировки имипенема должно начинаться после снижения клиренса ниже 70 мл/мин и у пациентов с массой тела менее 70 кг.
Как было указано ранее, эффективность карбапенемов зависит от продолжительности интервалов между введениями препарата, когда его концентрация выше МПК. Оптимизация фармакодинамических показателей может быть достигнута с помощью введения более высокой дозы, укорочения периода между введениями и увеличения продолжительности инфузии препарата [59]. Наиболее привлекательным методом является увеличение продолжительности инфузии, т.к. это позволяет оптимизировать фармакодинамические показатели без существенного увеличения экономических затрат. Однако продолжительность инфузии лимитирована стабильностью препарата в растворе: меропенем и имипенем при комнатной температуре должны быть введены в течение 3 часов; стабильность дорипенема достигает 12 часов [58,60]. В настоящее время продолжительная инфузия карбапенемов может рассматриваться в отношении меропенема и дорипенема. Однако максимально разрешенной дозировкой меропенема являются 6 г препарата в сутки, а дорипенема – 1,5 г/сут. Для оптимизации фармакодинамических показателей необходимо применение максимальной дозы и продолжительной инфузии препарата. Фармакодинамическое моделирование показало, что применение меропенема в дозе 6 г в сутки и 3–часовой инфузии создает условия для подавления флоры, которая интерпретируется при микробиологическом тестировании, как резистентная (до 64 мкг/мл). Возможность применения дорипенема в таких ситуациях ограничивается его низкой разрешенной суточной дозой (1,5 г).
Карбапенемы и судороги
Все ββ–лактамы способны вызывать судороги, особенно при неправильном дозировании в условиях нарушения функции почек или низкой массе тела, определенной хронической патологии или повышенной судорожной активности [61–64]. Повышение судорожной активности было выявлено еще в процессе проведения III фазы клинического исследования имипенема, а позже – меропенема и эртапенема [42,58,65]. Различные механизмы могут приводить к возникновению судорог, однако для карбапенемов основным механизмом является подавление рецепторов GABAa [66–67]. Показано, что боковая цепь во 2-м положении 5–членого кольца карбапенемов является ответственной за это осложнение. Причем при наиболее высокой концентрации (10 ммоль/л) имипенем подавляет 95% GABAа рецепторов, связывающих 3Н мусцимол, меропенем подавляет 49%, а дорипенем – 10% [68]. Этим механизмом объясняется возникновение судорог у 1,5–6% пациентов, получавших имипенем [61,69,70]. При ретроспективном исследовании дозозависимого эффекта было показано значение низкой массы тела, сниженной функции почек, наличия судорог в анамнезе, наличие другой патологии ЦНС и высоких доз имипенема/циластатина, которые нужно рассматривать в качестве факторов риска возникновения судорог [61]. Избыточной дозой имипенема/циластатина является та, которая превышает рекомендуемую дневную дозу на 25% и обычная доза у пациентов с нарушением функции почек или сопутствующей патологией ЦНС. Тщательный контроль дозирования препарата позволил снизить частоту возникновения судорог до уровня, который наблюдается при применении меропенема и эртапенема (~0,5%) [70–72].
Заключение
Карбапенемы в настоящее время остаются наиболее надежными препаратами для лечения нозокомиальных инфекций у тяжелых пациентов, особенно в случаях инфекций, вызванных резистентной флорой. С учетом современных тенденций роста и распространения резистентности нозокомиальной флоры карбапенемы являются основными препаратами для лечения инфекций, вызванных резистентными грамотрицательными микробами (энтеробактериями, P. aeruginosa, Acinetobacter spp.). Разрешенные суточные дозы и возможность продленной инфузии позволяют рассматривать меропенем, как единственный препарат, фармакодинамика которого может быть оптимизирована для подавления флоры, которая с микробиологических позиций определяется резистентной к меропенему и другим карбапенемам.
Литература.
1. Chow JW et al. Ann Intern Med. 1999; 115: 585–590.
2. Holmberg SD et al. Rev Infect Dis. 1987; 9: 1065–1078.
3. Phelps CE. Med Care. 1989; 27: 193–203.
4. Firtsche TR et al. Clin Microbiol Infect. 2005; 11: 974–984.
5. Ge Y et al. Antimicrob Agents Chemother. 2004; 48: 1384–1396.
6. Jones RN et al. J Antimicrob Chemother. 2004;54: 144–154.
7. Hammond ML. J Antimicrob Chemother. 2004;53 (Suppl.2): ii7–ii9.
8. Kohler TJ et al. Antimicrob Agents Chemother. 1999;43: 424–427.
9. Iso Y et al. J Antibiot. 1996; 49: 199–209.
10. Davis TA et al. ICAAC, 2006 (Abstract C1–0039)
11. Fujimura T et.al. Jpn J Chemother 2005; 53 (Suppl.1): 56–69.
12. Craig W. Diagn Microbiol Infect Dis 1995; 22:89–96.
13. Craig W. Clin Infect Dis 1998; 26: 1–12.
14. Craig W. Scand J Infect Dis 1991; 74: 63–70.
15. Wogelman D et al. J Infect Dis 1985; 152: 373–378.
16. Roosendaal R et al. J Infect Dis 1985; 152: 373–378
17. DeRyke CA et al. Drug. 2006; 66: 1–14.
18. Hanberger H et al. Eur J Clin Microbiol Infect Dis 1991; 10: 927–934.
19. Bustamante CI et al. Antimicrob Agents Chtmother. 1984; 26: 678–683.
20. Gudmundsson S et al. J Antimicrob chemother. 1986; 18: 67–73.
21. Nadler HL et al. J Antimicrob chemother. 1989; 24 (Suppl.1): 225–231.
22. Odenholt I. Expert Opin Investig Drugs. 2001; 10: 1157–1166.
23. Totsuka K, Kikuchi K. Jap J Chemother 2005; 53 (Suppl.1): 51–55.
24. Livermore DM et al. J Antimicrob chemother. 2003; 52: 331–344.
25. Pryka RD, Haig GM. Ann.Pharmacother. 1994; 28: 1045–1054.
26. Jones RN. Am J Med. 1985; 78 (Suppl.6A): 22–32.
27. Brown SD, Traczewski MM. J Antimicrob chemother. 2005; 55: 944–949.
28. Tsuji et al. Antimicrob Agents Chemother . 1998; 42: 94–99.
29. Cassidy PJ. Dev Ind Microbiol. 19881; 22: 181–209.
30. Miyashita K et al. Bioorg Med Chem Lett. 1996; 6: 319–322.
31. Hanson ND, Sanders CC. Curr Pharm Des 1999; 5: 881–894.
32. Hanson ND. J Antimicrob chemother. 2003; 52: 2–4.
33. Perez F, Hanson ND. J Antimicrob chemother. 2002; 40: 2153–2162.
34. Jacoby GA. Antimicrob Agents Chemother . 2006; 50: 1123–1129.
35. Bradford PA. Clin Microbiol Rev. 2001; 14: 933–951.
36. Jacoby GA. Eur J Clin Microbiol Infect Dis 1994; 13 (Suppl.1): 2–11.
37. Bonnet R. Antimicrob Agents Chemother . 2004; 48: 1–14.
38. Bradford PA et al. Clin Infect Dis 2004; 39: 55–60.
39. Jones RN et al. Diag Microbiol Infect Dis 2005; 52: 71–74.
40. Bonfigio G et al. Expert Opin Investig Drugs 2002; 11: 529–544.
41. Livermore DM et al. Antimicrob Agents Chemother 2001; 45: 2831–2837.
42. Mushtag S et al. Antimicrob Agents Chemother 2004; 48: 1313–1319.
43. Koh TN et al. Antimicrob Agents Chemother 2001; 45: 1939–1940.
44. Jacoby GA et al. Antimicrob Agents Chemother 2004; 48: 3203–3206.
45. Mertinez–Martinez L et a. Antimicrob Agents Chemother 1999; 43: 1669–1673.
46. Trias J, Nikaido H. Antimicrob Agents Chemother 1990; 34: 52–57.
47. Trias J, Nikaido H. J Biol Chem 1990; 265: 15680–15684.
48. Wolter DJ et al. FEMS Microbiol Lett. 2004; 236: 137–143.
49. Yoneyama H, Nakae T. Antimicrob Agents Chemother 1993; 37: 2385–2390.
50. Ochs MM et al. Antimicrob Agents Chemother 1999; 43: 1085–1090.
51. Sakyo S et al. J Antibiol. 2006; 59: 220–228.
52. Lister P. Antimicrob Agents Chemother 2005; 49: 4763–4766.
53. Fukuda H et al. Antimicrob Agents Chemother 1995; 39: 790–792.
54. Lister P, Wilter DJ. Ckin Infect Dis 2005; 40; S105–S114.
55. Masuda N et al. Antimicrob Agents Chemother 1995; 39: 645–649.
56. Masuda N et al. Antimicrob Agents Chemother 2000;44: 3322–3327.
57. Physicians’ Desk Reference. Thomson . 2005
58. Mattoes HM et al. Clin Ther. 2004; 26: 1187–1198.
59. Psathas P et al. American Society of Health–System Pharmacists. San Francisco, 2007; Abst 57E.
60. Calandra GB et al. Am J Med 1988; 84: 911–918
61. De Sarro A et al. Neuropharmacology 1989; 28: 359–365.
62. Williams PD et al. Antimicrob Agents Chemother. 1988; 32: 758–760.
63. Barrons RW et al. Ann Pharmacother. 1992; 26: 26–29.
64. Lucasti C et al. Europ Cong Clin Microbiol Infect Dis, 2007: Abstr. P834
65. Day LP e t al. Toxicol Lett. 1995; 76: 239–243.
66. Shimuda J et al. Drug Exp Clin Res 1992: 18: 377–381.
67. Horiuchi M et al. Toxicology. 2006; 222: 114–124.
68. Job MI, Dretler RH. Ann Pharmacother 1990; 24: 467–469.
69. Pestotnik SL et al. Ann Pharmacother 1993; 27: 497–501.
70. Rodloff AC et al. J Antimicrob Chemother. 2006; 58: 916–929.
71. Kearing GM, Perry CM. Drugs. 2005; 65: 2151–2178.
Белобородов В.Б., Грувер К.П.

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: