
Согласно последним данным National Hospital Ambulatory Medical Care Survey в США ежегодно выявляется более 7 млн. случаев инфекции мочевыводящих путей (ИМП) в амбулаторной практике, из них более 2 млн. обусловлены циститом, а 100 тыс. пациентов в год госпитализируются, преимущественно по поводу пиелонефрита [1]. ИМП в амбулаторной практике чаще встречается у женщин, при этом у 50% взрослых женщин имеется риск развития ИМП в течение жизни. В Великобритании в течение года около 2,5 млн. женщин отмечают эпизоды расстройств мочеиспускания, из них у 100 тыс. диагностируется рецидивирующая ИМП [2]. ИМП нередко наблюдается у молодых женщин в возрасте от 18 до 29 лет. В течение последующих 6–12 месяцев после первого эпизода ИМП у 25–40% из них развивается рецидивирующая неосложненная инфекция мочевыводящих путей. Около 15% всех назначений антибиотиков в амбулаторной практике в США связаны с ИМП [1].
Существуют различные виды классификации ИМП в зависимости от патогенетических механизмов, локализации процесса и других факторов (например, сопутствующих заболеваний). В настоящее время ИМП нередко разделяют на неосложненную и осложненную.
• Неосложненная ИМП выявляется чаще у женщин с анатомически и функционально нормальными мочевыводящими путями.
• Осложненная ИМП развивается на фоне нарушения уродинамики по обструктивному типу – при камнях различной локализации, стриктурах верхних мочевыводящих путей, инфравезикальной обструкции, а также у детей и лиц, перенесших различные медицинские манипуляции, что делает более трудными диагностику и лечение. Тяжелые формы ИМП требуют госпитализации и стационарного лечения.
В исследовании СОНАР (2005–2006 гг.) проанализированы данные о распространенности неосложненной ИМП в Российской Федерации, Республике Беларусь Казахстане и Кыргызстане. Полученные результаты свидетельствовали о том, что в возрасте 18–20 лет около 20% женщин имели в анамнезе, по крайней мере, один эпизод ИМП, а в более старших возрастных группах отмечен рост заболеваемости [3].
Наиболее частым клиническим проявлением носложненных инфекций мочевыводящих путей (НИМП), сопровождающимся расстройствами мочеиспускания и тазовыми болями, является цистит. Клиническое проявление заболевания зависит от типа уропатогенов, их вирулентности и резистентности к антимикробным агентам, а также, в известной степени, от общего состояния организма. Патогенез не всегда бывает достаточно ясен, многообразие специфических факторов, в том числе особенности взаимодействия между организмом пациента и внедрившимися микроорганизмами, определяет прогресс заболевания. Клинический опыт свидетельствует, что даже часто рецидивирующая неосложненная инфекция нижних мочевыводящих путей не всегда представляет угрозу для функции почек. Вместе с тем хорошо известен механизм «рефлюкс–пиелонефрита», развивающегося в отдельных случаях на фоне острого цистита. Адекватная и своевременно начатая антимикробная терапия у больных циститом не только приводит к более быстрому регрессу симптомов заболевания, но и является мерой профилактики поражения верхних мочевыводящих путей.
Рост резистентности основных уропатогенов ко многим антимикробным препаратам постоянно вызывает дискуссию о выборе эффективного метода лечения ИМП. Согласно существующим сегодня рекомендациям по лечению инфекционных заболеваний возбудитель должен быть идентифицирован и профиль его чувствительности к антибиотикам определен до начала терапии. При лечении больных с острыми клиническими проявлениями ИМП в большинстве случаев получение своевременных данных о профиле чувствительности уропатогенов не всегда возможно и первоочередной задачей специалистов в этой области является создание и постоянное обновление терапевтических рекомендаций.
Характеризуя антибактериальные препараты, которые могут использоваться в эмпирической терапии и профилактике ИМП, очевидно, что их антимикробный спектр должен быть адаптирован к перечню основных возбудителей ИМП. Наиболее низкий уровень резистентности уропатогенов наблюдается в странах Северной Европы и Австрии, а наиболее высокий – в Португалии и Испании. Последнее международное эпидемиологическое исследование при неосложненном цистите у женщин (ARESC) было проведено в 9 странах Европы (включая Россию) и Бразилии [4]. В ходе этого исследования определялась чувствительность уропатогенов к 9 антибиотикам (назначаемым per os), на основании требований Института клинических и лабораторных стандартов (CLSI). Согласно полученным данным основным уропатогеном являлась Escherichia coli (74,6%), далее Enterococcus faecalis (4,0%), Staphylococcus saprophyticus (3,6%), Klebsiella pneumoniae (3,5%) и Proteus mirabilis (3,5%).
На протяжении многих лет более 20 цефалоспориновых антибиотиков успешно применяются для лечения самых различных внебольничных и нозокомиальных инфекций. Согласно данным исследования, проведенного в 2008 г. Европейской ассоциацией урологов, в антимикробном лечении больных нозокомиальной ИМП 32,5% урологов отдают предпочтение фторхинолонам, 32,3% – цефалоспоринам (19,2% применяют цефалоспорины 3–го поколения), 12,3% – аминогликозидам и 9,5% специалистов применяют карбапенемы [5]. Отличительной чертой цефалоспоринов 3–го поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию β–лактамаз некоторых бактерий, длительный период полувыведения, что позволяет назначать эти препараты 1–2 раза в сутки. В условиях роста резистентности уропатогенов к фторхинолонам и ко–тримоксазолу, возрастает роль цефалоспоринов 3–го поколения в лечении неосложненной ИМП у амбулаторных больных. В отличие от таких антибиотиков, как фторхинолоны и ко–тримоксазол, цефалоспорины можно применять у детей и беременных женщин. Одним из наиболее изученных цефалоспоринов 3–го поколения для перорального приема является цефиксим, зарегистрированный в России под торговым названием «Цефорал Солютаб» (Астеллас Фарма Юроп Б.В., Нидерланды).
Фармакокинетика
и фармакодинамика цефиксима
Цефиксим является полусинтетическим цефалоспорином 3–го поколения для перорального применения, представляет собой [6R–[6альфа, 7бета(Z)]] –7–[[(2–Амино–4–тиазолил) [(карбоксиметокси)имино] ацетил]амино]–3–этенил–8–оксо–5–тиа–1–азабицикло[4.2.0]окт–2–ен–2–карбоновую кислоту. Препарат имеет замещающую гидроксиимино–аминотиазоловую боковую цепь в 7–й позиции. По сравнению с представителями I–II поколений, это обеспечивает высокую стабильность к β–лактамазам широкого спектра действия. Дополнительно введенная метоксиимино–группа еще более повышает устойчивость к β–лактамазам грамотрицательных бактерий.
Цефиксим проявляет высокую активность в отношении: Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Proteus mirabilis, Proteus vulgaris, Citrobacter diversus, Providencia rettgeri, Neisseria gonorrhoeae. Не действует на Staphylococcus aureus, Pseudomonas aeruginosa.
Препарат обладает высокой биодоступностью, которая составляет 40–52%. При этом следует отметить, что прием пищи не оказывает существенного влияния на его биодоступность и фармакокинетику [6,7]. Также было выявлено, что одновременный прием цефиксима с антацидами не оказывает значимого влияния на такие фармакокинетические параметры, как пиковая концентрация препарата в плазме (Cmax) или время больше МПК [8,9].
Показано, что после приема препарата в дозе 400 мг, Cmax цефиксима в сыворотке достигается между 3 и 5–м ч, медиана времени достижения пиковой концентрации (Tmax) составляет 4 ч. Пиковые концентрации в тканях достигаются позднее чем в сыворотке, Tmax для тканей составляет 6 ч [10].
В среднем, 12–20% цефиксима выводится в неизмененном виде почками в течение 24 ч при пероральном приеме препарата в дозе 200 мг, при внутривенном введении 200 мг цефиксима в течение 24 ч с мочой выводится в неизмененном виде 40,8% препарата. Аналогичный показатель при приеме внутрь составляет 21% для препарата, принимаемого в виде суспензии; 18% при приеме препарата в капсулах [10].
Цефиксим создает высокие концентрации во многих органах и тканях. В моче цефиксим создает концентрации, во много раз превышающие МПК большинства микроорганизмов, вызывающих ИМП. Изучено содержание цефиксима в моче при приеме препарата по 200 мг 2 р/сут. и 400 мг 1 р/сут. в течение 15 дней. На 15–й день, через 2–4 часа после приема последней дозы препарата, концентрация цефиксима в моче составила 29 мг/л при приеме в дозе 200 мг 2 р/сут. и 43 мг/л при приеме в дозе 400 мг 1 р/сут. [11]. Наряду с другими представителями β–лактамов цефиксим обладает бактерицидным действием, нарушая синтез клеточной стенки бактерий, каркас которой составляют пептидогликаны. Активность препарата обусловлена высоким сродством к пенициллинсвязывающим белкам (ПСБ) 3, 1a и 1b. Сродство в отношении ПСБ–1b объясняет высокую антимикробную активность цефиксима, сходную с другими пероральными цефалоспоринами – цефаклором и цефалексином. Отсутствие активности цефиксима в отношении S. aureus и коагулазонегативных стафилококков может быть объяснено низким сродством цефиксима к ПСБ–2 [12–14].
Клиническая эффективность
цефиксима при ИМП
Неосложненные ИМП
Больш|ая часть клинических исследований цефиксима при неосложненных ИМП проводилась преимущественно у пациентов с острым циститом, так как эта нозология является доминирующей в структуре внебольничных неосложненных ИМП. Наиболее часто для лечения данного заболевания использовали цефиксим в дозе 100 мг 2 р/сут. в течение 3–7 дней.
В исследовании японских ученых, включавшем 35 женщин с острым неосложненным циститом, цефиксим назначали по 100 мг 2 р/сут., в среднем в течение 3,9 дней. Клиническая эффективность и эрадикация возбудителя наблюдалась в 100% случаев [15].
Интерес представляют данные сравнительных рандомизированных исследований. Так, в Германии было проведено рандомизированное двойное слепое плацебо–контролируемое исследование эффективности однократного приема цефиксима, офлоксацина, ко–тримоксазола или плацебо в лечении неосложненных ИМП. В исследовании участвовали 80 женщин в возрасте от 18 до 35 лет с неосложненными ИМП. Пациентки случайным образом были распределены в одну из групп: принимавших однократно цефиксим в дозе 400 мг, офлоксацин 200 мг, ко–тримоксазол 160/800 мг или плацебо. Эффективность проводимой терапии оценивали через 14–17 дней. Терапия считалась эффективной при отсутствии бактериурии и клинической симптоматики. В данном исследовании было показано, что терапия цефиксимом эффективна в 89,4% случаев, офлоксацином в 89,4%, ко–тримоксазолом в 84,2% и плацебо в 26,3% [16].
Эффективность терапии неосложненных ИМП цефиксимом и ко–тримоксазолом изучали в двойном слепом исследовании, в которое было включено 528 пациентов, случайным образом разделенных на 3 группы: принимавшие цефиксим по 400 мг 1 р/сут., по 200 мг 2 р/сут. и ко–тримоксазол (триметоприм 160 мг + сульфаметоксазол 800 мг) по 1 таблетке 2 р/сут. Через 5–9 недель проводилась клиническая и микробиологическая оценка терапии. Исследование продемонстрировало равноценную микробиологическую эффективность препаратов во всех группах: прием цефиксима по 400 мг был эффективен в 100% случаев, по 200 мг – в 97%, а ко–тримоксазол – у 98% пациентов [17].
Американскими учеными было проведено многоцентровое исследование по сравнению эффективности цефиксима и амоксициллина с участием 565 взрослых пациентов с неосложненными ИМП. Случайным образом они были разделены на 2 группы: пациенты 1–й группы (n=279) принимали цефиксим по 400 мг 1 р/сут. в течение 10 дней, а пациенты 2–й группы (n=286) принимали амоксициллин в дозе 250 мг 3 р/сут. в течение 10 дней. Эффективность терапии оценивали через 7 дней после окончания лечения. Клиническая эффективность цефиксима составила 90%, амоксициллина – 83%, эрадикация уропатогенов наблюдалась у 92% пациентов, лечившихся цефиксимом, и у 84% пациентов, принимавших амоксициллин [18].
Осложненная ИМП
Под осложненной ИМП подразумевают инфекцию, возникающую на фоне структурных или функциональных нарушений мочевыводящих путей, или на фоне сопутствующих заболеваний, влияющих на защитные механизмы макроорганизма и повышающих риск развития реинфекции, рецидива или неэффективности лечения. Нозокомиальная ИМП, а также ИМП, вызванная резистентными штаммами микроорганизмов, относятся к осложненным. К микробиологическим особенностям осложненных ИМП относятся более широкий этиологический спектр, снижение роли E. coli, более высокая частота выделения резистентных бактерий, чем при неосложненных ИМП. К клиническим особенностям осложненных ИМП относят склонность к рецидивированию, более низкую эффективность антимикробной терапии.
Цефиксим исследовали у пациентов с относительно нетяжелыми формами осложненных ИМП – хроническим осложненным циститом и хроническим осложненным пиелонефритом. В основном для терапии данных ИМП использовали цефиксим в дозе 200 мг 2 р/сут., у небольшой части пациентов использовали дозу 400 мг 1 р/cут. В целом клинический опыт исследования цефиксима у пациентов с осложненными ИМП меньше, чем при неосложненных.
В серии исследований было установлено, что микробиологическая эффективность цефиксима при терапии осложненных ИМП составляла не менее 69% [19–23].
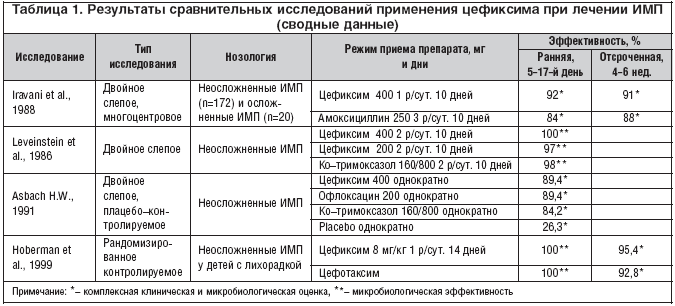
Основные уропатогены, вызывавшие инфекции мочевого тракта, принадлежали семейству Enterobacteriaceae, доминировала E. coli , которая элиминировалась во время лечения у 155 из 223 (69,5%) пациентов. В исследовании с участием 79 пациенток с осложненными ИМП, принимавших по 100 мг цефиксима 2 р/сут. на протяжении 5,9 дней, клиническая эффективность терапии составила 63%, а эрадикация возбудителя наблюдалась у 79% пациенток [15]. Данные об исследованиях по применению цефиксима при различных нозологиях из группы ИМП представлены в таблице 1.
Применение цефиксима в качестве компонента ступенчатой
антибактериальной терапии
Одним из достоинств цефиксима является возможность его использования в качестве пероральной части при проведении ступенчатой антибактериальной терапии ИМП.
Испанскими учеными было проведено рандомизированное контролируемое исследование по сравнению эффективности ступенчатой терапии острого неосложненного пиелонефрита с использованием 7 и 14–дневной терапии цефиксимом [24]. В исследовании участвовали 304 женщины, получившие однократно в/в инъекцию 1 г цефтриаксона, а затем случайным образом разделенные на группы: пациентки 1–й группы (n=153) после инъекции получали перорально по 400 мг цефиксима 1 р/сут. 7 дней, а пациентки 2–й группы (n=151) принимали цефиксим по 400 мг 1 р/сут. в течение 14 дней. В 96,6% случаев заболевания была выявлена E. coli. Клиническая и микробиологическая эффективность терапии оценивалась спустя 10–15 дней и 4–6 недель. Микробиологическая эффективность была достигнута в 79% случаев у пациенток 1–й группы и в 75,2% случаев во 2–й группе. Клиническая эффективность лечения была зарегистрирована в 92,2% случаев у пациенток 1–й группы и у 92,7% пациенток 2–й группы [24].
В многоцентровом рандомизированном клиническом исследовании была подтверждена эффективность и безопасность как самостоятельного приема цефиксима, так и его применения в качестве перорального компонента ступенчатой антибактериальной терапии ИМП, сопровождающихся подъемом температуры у детей [25]. В исследовании участвовало 306 детей в возрасте от 1 месяца до 2 лет с ИМП, сопровождающимися повышением температуры. Пациенты были разделены на группы: 1 – принимавшие цефиксим в дозе 8 мг/кг 1 р/сут. в течение 14 дней и 2 – получавшие в/в инъекции цефотаксима по 200 мг/кг/сут. (суточная доза распределялась на 4 введения) 3 дня или до тех пор, пока ректальная температура в течение 24 часов не будет ниже 38°С, затем данная группа пациентов получала перорально цефиксим (до достижения длительности курса терапии 14 дней). Стерильность мочи у пациентов 1–й группы была достигнута через 25 часов от начала лечения, а во 2–й – через 24 часа. В течение 6 месяцев после окончания терапии клинические и микробиологические симптомы рецидива инфекции отмечались у 5,3% детей, получавших цефиксим перорально, и у 8,5% детей, получавших ступенчатую терапию. Эпизоды бессимптомной бактериурии отмечались у 1 пациента, получавшего пероральную терапию, и у 2 детей, получавших ступенчатую терапию. Через 6 месяцев после проведения терапии морфологические изменения в почках наблюдались у 9,8% детей, принимавших цефиксим перорально, и у 7,2% пациентов, получавших ступенчатую терапию [25].
Антибиотикорезистентность
уропатогенной E. coli к цефиксиму
В связи с тем, что уропатогенная E. coli является возбудителем ИМП в подавляющем большинстве случаев, следует уделять особое внимание мониторингу устойчивости к антибактериальным препаратам именно данного микроорганизма [26–27].
На основании имеющихся зарубежных и отечественных данных можно сделать вывод о невысоком уровне резистентности к цефиксиму основного возбудителя внебольничных ИМП – E. coli в разных странах (табл. 2).
Полученные данные позволяют сделать вывод о вариабельности частоты выделения штаммов уропатогенной E. coli, устойчивых к цефиксиму в разных странах. Тем не менее в России наблюдается минимальная устойчивость этого возбудителя к цефиксиму, что позволяет рекомендовать его применение для лечения пациентов, страдающих преимущественно внебольничными формами ИМП. В условиях растущей резистентности возбудителей ИМП к традиционно используемым антибактериальным препаратам цефиксим (Цефорал Солютаб) становится одним из антибиотиков первого выбора для лечения НИМП.

Литература
1. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Am J Med 2002; 113 (Suppl 1A):5S–13S
2. Brufitt W, Hamilton–Miller JM. Prophylactic antibiotics for recurrent urinary tract infections. J Antimicrob Chemother 1990; 25(4):505–12.
3. Rafalskiy V., Khodnevich L. Eur Urol 2008; 3 (Suppl): 267
4. Naber KG et al. Surveillance study in Europe and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology in Females with Cystitis (ARESC): implications for empiric therapy. Eur Urol, 2008. 54(5): 1164–75.
5. TE Bjerklund Johansen. NAUTI: An update, 24 Annual EAU Congress 2009
6. Faulkner RD, Yocobi LA, Barone JS, Kaplan SA, Silber BM, al. e: Pharmacokinetic profile of cefixime in man. Pediatric Infectious Disease 1987b;6:963–970.
7. Faulkner RD, Fernandez P, Lawrence G, Falcowski AJ, Weiss AJ, al. e: Absolute bioavailability of cefixime in men. Journal of Clinical Pharmacology 1988d;28:700–706.
8. Healy D, Sahai J, Sterling L, Polk R, Racht E: Influence of ar/mg–containing antacids (a) on the pharmacokinethiсs (pk) of cefixime(c). Clinical Pharmacology and Therapeutics 1989;45:164.
9. Cephalosporins and Related Antibiotics. Drug Facts and Comparison. St. Luis, 2007 : 1930
10. Brogden RN, Campoli–Richards DM: Cefixime. A review of its antibacterial activity, pharmacokinetic properties and therapeutic potential. Drugs 1989;38:524–550.
11. Faulkner RD, Bohaychuk W, Desjardings RE, Look ZM , Haynes JD et al.: Pharmacokinetics of cefixime after once–a–day and twice–a–day dosing to steady state. Journal of Clinical Pharmacology 1987a;27:807–812.
12. Matsumoto Y, Kojo H, Kamimura T, Mine Y, Goto S, al. e: The mechanism of action of cefixime, a new oral cephalosporin. Chemotherapy 1985;33:123–133.
13. Neu HC: In vitro activity of a new broad spectrum β–lactamase–stable oral cephalosporin, cefixime. Pediatric Infectious Disease 1987;6:958–962.
14. O`Grady FW, Cowlishaw WA, Eley AR, al. e: Turbidometric studies of the effect of fk027 on the growth of aerobic and anaerobic bacteria. 14th International Congress of Chemotherapy, Kyoto,23–28 June, 1985Japan Convention Services, INC 1985
15. Kameoka H, Takano Y, Miyoshi S, al. e: Clinical experience with cefixime in urinary tract infections. The Japanese journal of antibiotics 1989;42:2540–2547.
16. Asbach HW: Single dose oral administration of cefixime 400 mg in the treatment of acute uncomplicated cystitis and gonorrhoea. Drugs 1991;42:10–13.
17. Levenstein J, Summerfield PJ, Fourie S, Brink G, Michaelides B, Murray E, Naidoo N: Comparison of cefixime and co–trimoxazole in acute uncomplicated urinary tract infection. A double–blind general practice study. South African Med J 1986;70:455–460.
18. Iravani A, Richard G, Johnson D, Bryant A: A double–blinding, multicenter comparative study of the safety and efficacy of cefixime versus amoxicillin in the treatment of acute urinary tract infections in adult patient. American Journal of Medicine 1988;85:17–25.
19. Akino H, Okano M, Isomatsu Y, Murunaka K, Kanimoto Y, al. e: Fundamental and clinical studies of cefixime. Chemotherapy 1985;33:638–649.
20. Hasegawa Y, Fujimoto Y, Takeda A, Kato N, Ito F, al. e: Usefulness of cefixime in urinary tract infection: Fundamental study in vitro model of urinary bladder and clinical study. Chemotherapy 1985;33:650–666.
21. Kishi H, Kitahara K, Tominaga T, Niijima T, Nishimura Y, al. e: Experimental and clinical studies on cefixime in urinary tract infections. Chemotherapy 1985;33:541–558.
22. Seko S, Sumii T, Nakano H, Nihira H, Okada K: Clinical studies of cefixime in the urological field. Chemotherapy 1985;33:735–750.
23. Washida H, Tsugaya M, Iwase Y, Hirao N, Sakagami H: Clinical studies of cefixime in the treatment of urinary tract infections. Chemotherapy 1985;33:667–694.
24. Mensa J, Morenzo–Martinez A, Martinez J, al. e: Treatment of acute uncomplicated pyelonephritis (aup): A randomized trial comparing 7– vs. 14–day therapy. Interscience Conference on Antimicrobial Agents and Chemotherapy 1999;39:26–29.
25. Hoberman A, Wald ER, Hickey RW, Baskin M, Charron M, Majd M, Kearney DH, Reynolds EA, Ruley J, Janosky JE: Oral versus initial intravenous therapy for urinary tract infections in young febrile children. Pediatrics 1999;104:79–86.
26. Naber KG, Schito G, Botto H, Palou J, Mazzei T: Surveillance study in Europe and Brazil on clinical aspects and antimicrobial resistance epidemiology in females with cystitis (aresc): Implications for empiric therapy. Eur Urol 2008;54:1164–1178.
27. Рафальский ВВ, Страчунский ЛС, Кречикова ОИ, Эйдельштейн ИА, с соавт.: Резистентность возбудителей амбулаторных инфекций мочевыводящих путей по данным многоцентровых микробиологических исследований UTIAP–I и UTIAP–II. Урология 2004;2:13–17.
28. Andreu A, Alos J, Gobernado M, al. e: Etiology and antimicrobial susceptibility among uropathogens causing community–acquired lower urinary tract infections: A nationwide surveillance study. Enfermedades infecciosas y microbiologia clinica 2005;1:1–3.
29. Sanchez Merino JM, Guillan Maquieira C, Fuster Foz C, Lopez Medrono R, Gonzalez Perez M, Raya Fernandez C, Garcia Alonso J: [evolution of Escherichia coli antibiotic resistances in urine samples from the community]. Arch Esp Urol 2008;61:776–780.
30. Яковлев С.В. Антибактериальная терапия внебольничных неосложненных инфекций мочевыводящих путей с позиций современного состояния антибиотикорезистентности. Российский Медицинский Журнал 2006;27:1998–2005.
31. Рафальский В.В., Белокрысенко С.С., Малев И.В., Деревицкий А.В., Галкин В.В., Остроумова М.В., Ляхова ОА: Чувствительность возбудителей инфекций мочевыводящих путей, выделенных в российской федерации к пероральному цефлоспорину III поколения цефиксиму. Лечащий врач 2008;8:27–29.
32. Hummers–Pradier E, Koch M, Ohse AM, Heizmann WR, Kochen MM: Antibiotic resistance of urinary pathogens in female general practice patients. Scandinavian journal of infectious diseases 2005;37:256–261.
Пушкарь Д.Ю., Зайцев А.В.
РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: