
Крапивница развивается вследствие высвобождения и синтеза главным образом – тучными клетками, расположенными в коже, различных медиаторов воспаления. Среди причин дегрануляции тучных клеток выделяют иммунные, неиммунные и идиопатические (неизвестные в настоящее время). В тех случаях, когда патофизиологический механизм хронической крапивницы точно неизвестен, ставится диагноз хронической идиопатической крапивницы (ХИК). Однако, по результатам исследований последних лет, у 25–45% пациентов с ХИК обнаруживаются IgG–антитела к высокоаффинному рецептору для иммуноглобулина Е (IgE) (FcεRI) или против самого IgE: полагают, что эти антитела «ответственны» за дегрануляцию тучных клеток и активацию воспаления. Основным методом лечения хронической крапивницы в случае выявления ее причины является терапия основного заболевания. При этом крапивница является лишь его составной частью – синдромом и исчезает на фоне его ремиссии. При ХИК в лечении на первый план выходят антагонисты H1–рецепторов гистамина, среди которых выделяется дезлоратадин (Эриус) ввиду его специфических свойств: помимо антигистаминного эффекта, установлено его противовоспалительное действие.
Крапивница характеризуется появлением зудящей, эритематозной сыпи, элементы которой возвышаются над поверхностью кожи. Первичным элементом при крапивнице является волдырь (urtica). Он бледнеет при надавливании, что указывает на наличие в очагах поражения кожи расширенных кровеносных сосудов и отека. При микроскопическом исследовании у больных крапивницей выявляют расширение мелких венул и капилляров, затрагивающее поверхностные слои кожи, и в меньшей степени – ее сосочковый слой, а также отек волокон коллагена. Более выраженное воспаление, при котором аналогичные изменения развиваются в глубоких слоях кожи и подкожной клетчатке, приводит к развитию отека Квинке (ангионевротического отека). Крапивница может появляться на любых участках кожи, в то время как отеки Квинке наиболее часто возникают в области лица, языка, конечностей и половых органов. Уртикарная сыпь сопровождается зудом, который усиливается ночью и сохраняется в течение от нескольких минут до 48 часов [1]. Спустя указанный срок элементы сыпи бесследно исчезают, однако новые высыпания могут появляться в разное время на других участках тела [2,3]. По течению выделяют острую (до 6 недель) или хроническую (более 6 недель) крапивницу. При неоднократном появлении уртикарной сыпи констатируют рецидивирующую крапивницу. Распространенность крапивницы у детей составляет около 2–3%, при этом хотя бы один эпизод крапивницы в течение всей жизни возникает у 15–20% как детского, так и взрослого населения [4,5].
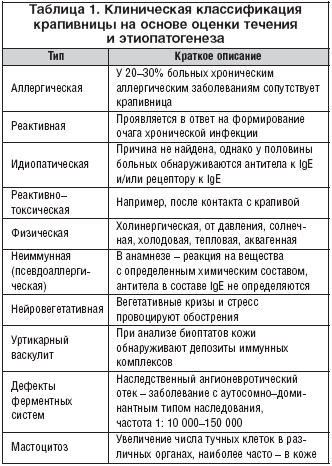
Существует множество классификаций хронической крапивницы, в которых учитываются как клинические проявления болезни, так и ее этиология, однако учет патогенеза заболевания является наиболее приемлемым для выбора терапии (табл. 1) [1].
Таким образом, крапивницей как нозологической формой можно обозначить только ее идиопатический тип и связанную с воздействием физических факторов; во всех остальных случаях она является лишь синдромом, причины которого различны. Наиболее часто крапивница возникает при:
• аллергических и неаллергических реакциях на лекарственные препараты, пищу и пищевые добавки, ингаляционные аллергены (пыльца растений, плесневые грибы, домашняя пыль);
• внутривенном введении препаратов крови и кровезаменителей;
• инфекциях: бактериальных, грибковых, вирусных и паразитарных;
• укусах и ужалениях насекомых
• системных заболеваниях соединительной ткани
• сывороточной болезни
• злокачественных новообразованиях, сопровождающихся приобретенным дефицитом C1 и C1–инактиватора комплемента.
Острая крапивница у детей наиболее часто связана с пищевой, лекарственной, инсектной аллергией, а также с вирусной инфекцией. При этом у половины больных причину уртикарной сыпи выявить не удается – такая крапивница обозначается, как идиопатическая. При хронической крапивнице лишь у 20–30% детей удается установить ее причину, которая наиболее часто представлена физическими факторами, инфекциями, пищевой аллергией, пищевыми добавками, ингаляционными аллергенами и медикаментами. Однако ограничиваться дифференциальной диагностикой аллергических, инфекционных и физических причин крапивницы, как это делается обычно в практике педиатра и аллерголога, не следует. Во всех случаях хронической крапивницы необходимо исключение широкого спектра заболеваний [6].
Уртикарная сыпь, возникающая при воздействии физических факторов, является наиболее частым типом хронической крапивницы [7]. При физической крапивнице зудящая уртикарная сыпь появляется непосредственно после воздействия соответствующего провоцирующего фактора и сохраняется обычно не более нескольких часов. Исключением является крапивница вследствие замедленной реакции на давление, при которой сыпь появляется через 2–6 часов после давления и сохраняется свыше суток. В отличие от других типов физической крапивницы замедленная крапивница от давления плохо поддается лечению антигистаминами (антагонистами H1–гистаминовых рецепторов); при ее тяжелом течении нередко приходится назначать большие дозы глюкокортикостероидов системного действия [8]. Наиболее частыми причинами физической крапивницы являются давление (помимо замедленной крапивницы от давления педиатру часто приходится сталкиваться с дермографической крапивницей, уртикарным дермографизмом, когда трение вызывает сыпь); перегревание или физическая нагрузка (вызывают холинергическую крапивницу); солнечный свет (солнечная крапивница), холод (холодовая крапивница) и вода (аквагенная крапивница) [9,10].
Другим часто встречающимся типом крапивницы является контактная. Она может быть аллергической или неаллергической (иные термины – псевдоаллергическая, реактивно–токсическая). Неаллергические «провокаторы» уртикарной сыпи при контактной крапивнице широко распространены в окружающей среде. К ним относятся различные химические компоненты пищевых продуктов, косметических средств, предметы бытовой химии и лекарственные препараты. Аллергическая контактная крапивница, как проявление IgE–опосредованной аллергической реакции, наиболее часто наблюдается у детей с аллергическими заболеваниями и, как правило, основным медиатором, вызывающим воспаление, является гистамин. Наиболее часто такая сыпь возникает при контакте с моющими веществами, латексом, свежими фруктами, ягодами и овощами у больных поллинозом. При этом типе крапивницы основным является выявление причинно–значимого аллергена и его устранение. В качестве средства первоочередной помощи используют наружные кортикостероиды и антигистаминные препараты [11].
Роль инфекционных заболеваний, особенно паразитарных инвазий, в возникновении крапивницы окончательно не установлена. Большинство исследователей указывают на то, что частота инфекций, как бактериальных, вирусных, грибковых, так и паразитарных, у больных крапивницей не отличается от таковой в общей популяции, однако существует и противоположная точка зрения, согласно которой инвазия желудочно–кишечного тракта паразитами считается важной причиной крапивницы. Подавляющее большинство имеющихся публикаций не соответствуют критериям доказательной медицины, поэтому с этой точки зрения их достоверность оценить нельзя. Единичные, а также недостаточно выдержанные соответственно правилам доказательной медицины сообщения касаются хронической крапивницы у детей и взрослых, ассоциированной с инфекцией вирусами Эпштейна–Барра, гриппа, парагриппа и цитомегаловирусом. Анализ редких описаний случаев хронической крапивницы, ассоциированной с различными бактериальными и грибковыми инфекциями не позволяет точно выявить – связана ли уртикарная сыпь с микроорганизмами, или она является побочной реакцией на лечение антибактериальными и противогрибковыми препаратами [12]. Инфекция Helicobacter pylori также рассматривается в связи с хронической крапивницей. Установлено, что частота ее выявления среди больных крапивницей и в популяции одинакова. Однако, иммунный ответ на H. рylori у пациентов с крапивницей может отличаться. Выявлено, что у больных хронической крапивницей, инфицированных H. рylori, определяется более выраженная, чем у инфицированных пациентов без крапивницы, продукция иммуноглобулина G, а также иммуноглобулина An, специфичного к липопротеину lpp20. Этот липопротеид ассоциирован с H. рylori и может рассматриваться в качестве одного из маркеров данной инфекции. Более того, анализ существующих исследований выявил, что ремиссия крапивницы более вероятна в тех случаях, когда антибактериальная терапия приводит к эрадикации H. рylori.
Авторы этих исследований заключают, что после исключения других наиболее вероятных причин крапивницы целесообразно провести тестирование на выявление H. pylori; при выявлении инфекции – назначить соответствующее лечение и убедиться в эрадикации возбудителя [13].
Стрептококки группы А также рассматриваются, как возможный фактор, играющий роль в возникновении крапивницы. При хронической крапивнице нередко обнаруживают антитела к этим микроорганизмам, отмечают эффект от лечения эритромицином, амоксициллином, цефуроксимом. Однако и эти данные касаются очень малых групп пациентов и не могут считаться доказательством роли стрептококков в развитии уртикарной сыпи [12]. Значительное число паразитарных инвазий, включающих Ascaris, Ancylostoma, Strongyloides, Filaria, Echinococcus, Schistosoma, Trichinella, Toxocara, Fasciola, ассоциированы с крапивницей. Реакции немедленной гиперчувствительности, такие как крапивница и ангионевротические отеки, возникают в миграционную фазу развития паразита. Указанные паразитарные инфекции обычно сопровождаются выраженной эозинофилией, поэтому их не стоит включать в план дифференциального диагноза при отсутствии у больного соответствующей клинической картины и повышенного числа эозинофилов в периферической крови. Что касается роли простейших в развитии крапивницы, то большинство исследователей обсуждают лямблиоз, однако единого мнения о роли лямблий при крапивнице нет. Некоторые авторы считают появление уртикарной сыпи при лямблиозе редким явлением [14], другие убеждены в несомненном наличии такой ассоциации [15]. Более того, полагают, что проявления пищевой, лекарственной аллергии могут усиливаться в период манифестации паразитоза, что существенно усложняет дифференциальную диагностику и приводит к хроническому течению крапивницы [16].
Редкими типами хронической крапивницы являются уртикарный васкулит, наследственный ангионевротический отек и мастоцитоз. Следует подчеркнуть, что уртикарные высыпания, сохраняющиеся дольше 24–х часов и, особенно – оставляющие после себя пигментацию, в основе могут иметь иммунокомплексную природу. Это указывает на необходимость исключения уртикарного васкулита, который является характерным признаком аутоиммунного заболевания, в первую очередь – системной красной волчанки [1]. Наследственный ангионевротический отек – редкое аутосомно–доминантное заболевание, в основе которого лежит дефицит ингибитора C1–компонента комплемента. Заболевание проявляется рецидивирующими отеками, отличительной характеристикой которых является отсутствие зуда. Термин «мастоцитоз» объединяет гетерогенную группу заболеваний, основу которых составляют аномальный рост и накопление тучных клеток. Крапивница при мастоцитозе (пигментная крапивница) может входить в симптомокомплекс системного мастоцитоза, при котором поражаются различные органы или являться самостоятельным заболеванием (в этих случаях говорят о кожной форме мастоцитоза) [17]. Эти редко встречающиеся типы хронической крапивницы наиболее резистентны к терапии. Антигистаминные препараты при таких уртикарных сыпях дают непостоянный и, как правило, недостаточный эффект. Это можно объяснить тем, что в развитии воспаления при крапивнице, сопутствующей системным заболеваниям, участвуют не только гистамин, но и другие медиаторы, а также клеточные иммунные реакции и опосредованные системой комплемента.
Если причину хронической крапивницы в ходе обследования установить не удалось, ставят диагноз: «хроническаая идиопатическая крапивница» (ХИК). При ХИК уртикарные элементы сохраняются дольше, чем при различного рода физической крапивнице – обычно до 8–12 часов и сопровождаются более выраженным зудом, особенно – вечером и ночью. У половины больных хронической идиопатической крапивницой сопутствуют отеки Квинке [8]. При ХИК у 25–45% больных обнаруживают признаки аутоиммунного заболевания – гистамин–высвобождающие IgG–антитела против высокоаффинного рецептора для IgE (FcεRI) или против самого IgE [18]. У больных, имеющих такие антитела, в сравнении с теми, у кого они отсутствуют, уровень сывороточного IgE существенно ниже, а обильная и распространенная уртикарная сыпь характеризуется выраженным зудом [19]. При исследовании биоптатов кожи у пациентов с ХИК и наличием FcεRI/IgE–антител нередко выявляют периваскулярные инфильтраты, в основном состоящие из нейтрофилов, эозинофилов и мононуклеарных клеток [20]. Почти у трети больных ХИК выявляются аутоиммунные реакции на ткань щитовидной железы. При этом у большинства из них отсутствуют какие–либо клинические симптомы поражения щитовидной железы и изменение уровней тиреоидных гормонов, отмечается уменьшение или исчезновение симптомов крапивницы после назначения левотироксина [18,21,22].
Помимо оценки анамнеза, клинических симптомов заболевания и его течения, в проведении дифференциального диагноза хронических крапивниц помогают следующие лабораторные исследования:
• Кожные тесты или определение специфических IgE–антител в крови. Помогают выявить «причинно–значимый» аллерген в тех случаях, когда анамнестические данные позволяют заподозрить связь сыпи с пищей, лекарственными средствами, укусами насекомых, пыльцой растений, животными. Отрицательные результаты этих тестов позволяют исключить атопический компонент крапивницы.
• Посев (как правило, из зева или другого очага воспаления) для выделения культуры бактерий и определения их чувствительности к медикаментам. Используется при подозрении или наличии очага воспаления или если у больного в анамнезе отмечались лихорадка или боль в горле.
• Тесты функции щитовидной железы, включая антитиреоидные микросомальные антитела и антитела к тиреоглобулину. В первую очередь следует использовать эти тесты, если среди ближайших родственников пациента есть заболевания щитовидной железы (чаще всего по женской линии) или симптомы, указывающие на снижение ее функции. Однако при наличии аутоантител к щитовидной железе ее функция часто не нарушена.
• Определение концентрации ингибитора C1–эстеразы, уровня C3 и C4 компонентов комплемента. Следует использовать эти тесты, если у родственников ребенка отмечались случаи отеков Квинке или обострение крапивницы сопровождалось затруднением глотания, дыхания или ангионевротическими отеками.
• Анализ кала для обнаружения яиц гельминтов или паразитов. Особо следует обратить внимание на данное исследование, если в анамнезе есть указания на употребление недостаточно проваренного/прожаренного мяса, проживание в условиях неудовлетворительного санитарного состояния.
• Тесты на наличие аутоантител: антинуклеарные антитела, антитела к ДНК, антитела против FcεR1α. Особенно важно провести эти исследования, если у больного отмечаются артрит, фотосенсибилизация или другие симптомы, указывающие на вероятность системного заболевания соединительной ткани. Наличие положительной реакции в виде образования волдыря и гиперемии при проведении кожного теста с собственной сывороткой крови пациента позволяет предположить наличие аутоантител к FcεRI/IgE [23].
• Анализ клеток крови, СОЭ, уровня C–реактивного белка. Является обязательным компонентом обследования, позволяет исключить заболевания, сопровождающиеся воспалением, в том числе – системные васкулиты.
• Определение уровня холодовых агглютининов и криоглобулинов в крови у детей с холодовой крапивницей. Обнаружение криоглобулина требует дальнейшего исключения хронического гепатита или злокачественного новообразования.
• Выявление H. pylori и лечение этой инфекции помогают некоторым больным избавиться от крапивницы.
Дополнительные исследования:
• Наличие крапивницы, вызванной физическими факторами, можно подтвердить с помощью соответствующих провокационных тестов: с нагреванием, давлением, холодом, солнечным светом, водой, физической нагрузкой, вибрацией.
• Переносимость пищи, в том числе той, к которой выявлена сенсибилизация с помощью кожных тестов или определения специфического IgE в крови, следует проверить пробной диетой. Подозреваемый продукт и его содержащие исключают на несколько дней, после чего продукт вводится в питание вновь. Методика элиминационно–провокационной диеты изложена в соответствующих руководствах. Следует помнить о крапивнице, которая возникает только при сочетании пищевой провокации (например, употребление морепродуктов) и физической нагрузки.
Практические советы:
• При наличии у ребенка раннего возраста хронической крапивницы следует в первую очередь исключить системные заболевания (системную красную волчанку, дерматомиозит, синдром сывороточной болезни, скрытую инфекцию, злокачественное новообразование). Аналогично – у детей старшего возраста, если выявляются, помимо крапивницы, какие–либо неспецифические симптомы (особенно – прогрессирующие).
• Если высыпание при крапивнице сохраняется более 24 часов, следует исключать уртикарный васкулит. В этих случаях показано микроскопическое исследование биоптата кожи.
• Если состояние больного не нарушено и сыпь появляется и исчезает (или мигрирует) менее чем в течение 24 часов, целесообразно в первую очередь исключить:
– инфекцию мочевой системы, особенно вызванную Escherichia coli;
– инфекцию верхних дыхательных путей, вызванную стрептококками;
– инфекцию Chlamydia pneumoniae;
– инфекцию H. pylori;
– герпес–вирусную инфекцию, вызванную цитомегаловирусом, вирусом Эпштейна–Барра, вирусом герпеса 6 типа;
– паразитарную инвазию (особенно если ребенок проживает в неблагоприятных санитарно–эпидемиологических условиях или недавно выезжал в другие регионы);
– аутоиммунные заболевания (аутоиммунные заболевания щитовидной железы, целиакию, сахарный диабет 1 типа, системный ювенильный ревматоидный артрит, воспалительные заболевания кишечника).
• При отсутствии сопутствующих крапивнице симптомов в первую очередь следует исключить воздействие физических факторов, как причину крапивницы (солнечный свет, холод, перегревание, воду, вибрацию, давление и др.).
• Провести лечение имеющихся или выявленных в ходе обследования заболеваний. Если крапивница сохраняется и все возможные причины исключены, признать ее идиопатической, назначить лечение. В случае сомнения – провести дообследование.
Основным медикаментозным лечением крапивницы (как острой, так и хронической) являются антигистаминные препараты. Несмотря на то, что антигистамины первого поколения (дифенгидрамин, гидроксизин и др.) эффективно устраняют симптомы крапивницы, их назначение сопряжено с возникновением большого числа побочных эффектов. К ним относятся сонливость, антихолинергический эффект (сухость слизистых оболочек, головокружение, запор, задержка мочеиспускания и др.), нарушение памяти, внимания, которые могут сохраняться в течение суток после приема препарата. В соответствии с международным руководством по лечению крапивницы (EAACI/GA2LEN/EDF/WAO management guideline) антигистаминные препараты первого поколения (седативные) не должны использоваться в качестве первоочередного лечения больных крапивницей. Исключением могут быть только те ситуации, при которых невозможно использование антигистаминов 2 поколения. В настоящее время первоочередным считается назначение неседативных антигистаминов 2 поколения. Эти препараты, лишенные побочных эффектов, присущих антигистаминным средствам 1 поколения, не менее эффективно блокируют Н1–рецепторы к гистамину и подавляют симптомы крапивницы, существенно улучшая качество жизни больных [24,25].
Среди неседативных антигистаминных препаратов особого внимания заслуживает дезлоратадин (Эриус), являющийся первичным фармакологически активным метаболитом хорошо известного лоратадина. Дезлоратадин – селективный антагонист H1–рецепторов. Он обладает особыми фармакокинетическими свойствами: быстрая абсорбция, на его биодоступность не влияют ни прием пищи и ее характер, ни питье соков. Период полураспада Эриуса составляет 21–27 часов, что позволяет сохранять его реальную терапевтическую активность неизменной при однократном приеме в сутки (в отличие от других антигистаминных препаратов второго поколения). Более того, исследование совместимости дезлоратадина с другими лекарственными препаратами не выявило каких–либо значимых взаимодействий. Профиль безопасности Эриуса сравним с таковым при применении плацебо, что было установлено в контролируемом клиническом исследовании с участием около 2000 пациентов, получавших препарат в дозе 5 мг ежедневно [26].
В ходе лабораторных исследований было установлено, что дезлоратадин обладает выраженной способностью связываться с Н1–рецепторами к гистамину; его активность в блокировании этих рецепторов превосходит таковую всех существующих на сегодняшний день антигистаминных препаратов. Отличительной особенностью Эриуса от других противоаллергических препаратов второго поколения является тройной механизм действия: дезлоратадин не только блокирует Н1–гистаминовые рецепторы, но и обладает выраженной противоаллергической и противовоспалительной активностью посредством ингибирования синтеза множества других медиаторов тучными клетками, базофилами и другими клетками, участвующими в развитии воспаления [27]. К этим провоспалительным медиаторам относятся лейкотриен C4, простагландин D2, триптаза, RANTES, индуцируемый фактором некроза опухоли–альфа, P–селектин, молекула межклеточной адгезии–1 (ICAM–1), активирующаяся гистамином, некоторые интерлейкины (IL–1β, IL–4, IL–5, IL–6, IL–8, IL–13, IL–18) и фактор активации тромбоцитов. Указанные медиаторы воспаления играют роль при любых аллергических и псевдоаллергических реакциях, поэтому дезлоратадин оказывает противовоспалительное действие при различных проявлениях как дыхательной, так и кожной аллергии и их клинических аналогах псевдоаллергического генеза. Эффективность Эриуса в подавлении воспаления в коже отчасти объясняется также подавлением активации кератиноцитов, в частности – торможением способности гамма–интерферона вызывать экспрессию ICAM–1, лейкоцитарного антигена–DR (HLA–DR) и активацию главного комплекса гистосовместимости I класса, а также – высвобождение RANTES иинтерлейкина–18 [28].
Таким образом, Эриус тормозит развитие не только ранней, но и поздней фазы аллергической реакции, которая связана с накоплением «клеток воспаления» в очаге поражения. Этот уникальный фармакологический эффект дезлоратадина подавляет формирование хронического воспаления, которое при отсутствии адекватной терапии может привести к затяжному течению болезни. Дополнительным подтверждением противовоспалительной активности дезлоратадина, связанной с подавлением не только аллергического воспаления, является его способность тормозить развитие эритемы при воздействии ультрафиолетового излучения В–диапазона [29].
Клиническая эффективность и безопасность дезлоратадина при ХИК была доказана при проведении мультицентровых рандомизированных плацебо–контролируемых исследований с помощью двойного слепого метода. Эффективность Эриуса в отношении подавления зуда отмечалась с первого дня применения препарата и сохранялась в течение последующих 6 недель исследования. Помимо зуда, использование дезлоратадина приводило к устранению/существенному уменьшению выраженности таких симптомов ХИК, как нарушение сна, снижение активности и работоспособности пациента. При этом побочные эффекты отсутствовали [30].
Таким образом, применение Эриуса при хронической крапивнице сопровождается существенным улучшением качества жизни больных. Эффективное подавление симптомов крапивницы наступает уже в первые сутки лечения, продолжается весь период применения препарата и заключается в быстром и стойком уменьшении сыпи, зуда, улучшении сна и активности пациентов в дневное время.
Среди других лекарственных препаратов для лечения хронической крапивницы следует отметить блокаторы Н2–рецепторов к гистамину. Они не используются в качестве стандартного лечения, однако их сочетанное применение с Н1–антагонистами у некоторых больных достоверно повышает эффективность лечения [8]. Лечение больных хронической крапивницей глюкокортикостероидами также не является методом стандартной терапии, так как его эффективность неоднозначна. Это лечение, как полагают, может дать результат и показано при наличии у больного аутоантител к FcεRI/IgEа, а также при тяжелом течении крапивницы. У этого контингента больных возможен эффект от применения циклоспорина [31] и внутривенного введения иммуноглобулинов [32].
Литература
1. Ring J, Brockow K, Ollert M, Engst R.Antihistaminesinurticaria. ClinExpAllergy 1999;29(Suppl. 1):31–37.
2. Simons F.E.R. Prevention of acute urticaria in young children with atopic dermatitis. J. of Allergy and Clin Immunology, 2001;107(4):703–706.
3. Warin RP, Champion RH: Urticaria, London, 1974, WB Saunders.
4. Гервазиева В.Б., Петрова Т.И. Экология и аллергические заболевания у детей. Аллергология и иммунология, 2000;1(1):101–108.
5. Аллергические болезни у детей. Руководство для врачей. Под ред. М.Я. Студеникина, И.И. Балаболкина. М., Медицина, 1998.–347с.
6. Novembre E, Cianferoni A, Mori F, et al. Urticaria and urticaria related skin condition/disease in children. Eur Ann Allergy ClinImmunol 2008: 40: 5–13.
7. Barlow RJ, Warburton F, Watson K, Black AK, Greaves MW. Diagnosis and incidence of delayed pressure urticaria in patients with chronic urticaria.J Am Acad Dermatol 1993;29: 954–958.
8. Greaves M. Chronic urticaria. J Allergy ClinImmunol 2000;105: 664–672.
9. Monfrecola G, Masturzo E, Riccardo AM, Balato F, Ayala F, Di Costanzo MP. Solar urticaria: a report on 57 cases. Am J Contact Dermatol 2000;11: 89–94.
10. LuongKV, NguyenLT. Aquagenic urticaria: report of a case and review of the literature. AnnAllergyAsthmaImmunol 1998;80: 483–485.
11. Wakelin SH.Contact urticaria. Clin Exp Dermatol 2001;26: 132–136.
12. Chronic urticaria and infection. Current Opinion in Allergy and Clinical Immunology 2004, 4:387–396.
13. Wustlich S, Brehler R, Luger TA, et al. Helicobacter pylori as a Possible Bacterial Focus of Chronic Urticaria. Dermatology, 1999;198:130–132.
14. Hill DR, Nash TE: Intestinal flagellate and ciliate infections. In Guerrant RL, Walker DH, Weller PF (eds): Tropical Infectious Diseases. Philadelphia, Churchill Livingstone, 1999, pp 703–719.
15. Дерматозы и паразитарные болезни у детей и подростков. Практическое пособие. Екатеринбург: Издательство Уральского университета, 2006, 61 с.
16. I. A. Khan, M. A. Khan. Urticaria and Enteric Parasitosis: an agonizing condition. Med. Channel, 1999; 5(4):25–28.
17. Valent P, Horny HP, Escribano L et al. Diagnostic criteria and classification of mastocytosis: a consensus proposal. Leuk Res 2001;25: 603–625.
18. Ryhal B, Demera RS, Choenfeld Y, Peter JB, Gershwin ME. Are autoantibodies present in patients with subacute and chronic urticaria? J Invest ClinImmunol 2001;11: 16–20.
19. Sabroe RA, Seed PT, Francis DM, Barr RM, Black AK, Greaves MW. Chronic idiopathic urticaria: comparison of the clinical features of patients with and without anti–FeRI or anti–IgE autoantibodies. J Am AcadDermatol 1999;40: 443–450.
20. Grattan C, Boon AP, Eady RA, Winkelmann RK. The pathology of the autologous serum skin test response in chronic urticaria resembles IgE–mediated late–phase reactions. Int Arch Allergy Appl Immunol 1990;93: 198–204.
21. Gaig P, Garcia–Ortega P, Enrique E, Richart C. Successful treatment of chronic idiopathic urticaria associated with thyroid autoimmunity. J Invest Allergol Clin Immunol 2000;10: 342–345.
22. Zauli D, Deleonarid G, Goderaro S et al. Thyroid autoimmunity in chronic urticaria. Allergy Asthma Proc 2001;22: 93–95.
23. Sabroe RA, Grattan CE, Francis DM, Barr RM, Kobza Black A, Greaves MW. The autologous serum skin test: a screening test for autoantibodies in chronic idiopathic urticaria. Br J Dermatol 1999;140: 446–452.
24. Zuberbier T, Greaves MW, Juhlin L, Mark H, Stingl G, Henz BM. Management of urticaria: a consensus report. J Invest Dermatol Symp Proc 2001;6: 128–131.
25. [Guideline] Zuberbier T, Asero R, Bindslev–Jensen C, Walter Canonica G, Church MK, Gimenez–Arnau AM, et al. EAACI/GA(2)LEN/EDF/WAO guideline: management of urticaria. Allergy.Oct 2009;64(10):1427–43.
26. Geha RS, Meltzer EO. Desloratadine: a new, nonsedating, oral antihistamine. J Allergy Clin Immunol 2001;107: 751–762.
27. Bachert C. Therapeutic points of intervention and clinical implications: role of desloratadine. ClinExpImmunol 2002.
28. Munster I, Pleyl–Wisgiki G, Traidl–Hoffmann C, Ring J, Behrendt H. Desloratadine regulates the expression of MHC–class molecules and costimulatory signals in cultured human keratinocytes. Allergy 2002;57(Suppl. 73):307–308.
29. Reuther T, Williams SC, Kerscher M. Anti–inflammatory activity of desloratadine: a pilot study. Poster abstract presented at 20th World Congress of Dermatology, 4–5 July 2002, Paris, France.
30. Ring J, Hein R, Gauger A, Bronsky E, Miller B. Once–daily desloratadine improves the signs and symptoms of chronic idiopathic urticaria: a randomized, double–blind, placebo–controlled study. Int J Dermatol 2001;40: 72–76.
31. Grattan C, O’Donnell BF, Francis DM et al. Randomized double–blind study of cyclosporin in chronic ‘idiopathic’ urticaria. Br J Dermatol 2000;143: 365–372.
32. O’Donnell BF, Barr RM, Black AK et al. Intravenous immunoglobulin in autoimmune chronic urticaria. Br J Dermatol 1998;138: 101–106.

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: