
В динамике развития многих заболеваний возникает состояние интоксикации (токсикоза), во многом определяющее тяжесть и исход болезни. При этом эндотоксины из очага образования (воспаление, синтез патологических белков печенью) с током крови попадают в органы фиксации и биотрансформации (печень, иммунная система, легкие), органы выделения патологических веществ (печень, почки, желудочно–кишечный тракт, легкие, кожа), ткани депонирования патологических структур (жировая, нервная, костная ткань, органы эндокринной системы, лимфоидная ткань). Когда количество токсинов превышает возможности их биотрансформации, развивается синдром эндогенной интоксикации [1].
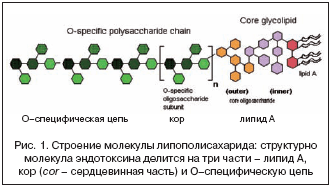
В инфекционной патологии чаще всего синдром эндогенной интоксикации встречается при острых кишечных инфекциях, возбудители которых определяют накопление эндотоксинов – липополисахаридов, связанных с наружной мембраной бактерий и состоящих из липида A, полисахаридного ядра и боковой цепи – O–полисахарида (рис. 1).
Наиболее значимы эндотоксины грамотрицательных бактерии. На внешней стенке одной грамотрицательной бактерии может содержаться до 3,5 млн. молекул липополисахаридов. После гибели клеток эндотоксины этих бактерий остаются биологически активными молекулами.
Помимо липополисахаридов, в состав внешней стенки грамотрицательных бактерий входят и белки, так как внешняя мембрана на 3/4 состоит из липополисахаридов, 1/4 приходится на белковые компоненты. Эти белки вместе с липополисахаридами образуют белково–липополисахаридные комплексы разного размера и молекулярной массы. Эти комплексы и называют бактериальными эндотоксинами, именно они обеспечивают структурную целостность бактерий, ответственны за многие их функции (в том числе определяют патогенные и антигенные свойства бактерий) [2].
Образующиеся в ЖКТ эндотоксины вызывают деструкцию белков и липидов клеток организма, блокируют синтетические и окислительные процессы [3]. Эндотоксины оказывают прямое и опосредованное воздействие на структуру клеток, сами клетки, системы и органы (отдаленное действие). По действию на уровне клеточных структур С.А. Симбирцев и Н.А. Беляков (1994) классифицируют эндотоксины следующим образом: обладающие цитолитическим эффектом; активаторы лизосомальных ферментов; блокаторы митохондриальной энергетики; инициаторы свободнорадикальных процессов; ингибиторы рибосомального синтеза; способные к воздействию на различные клеточные образования.
Отдаленное действие эндотоксинов выражается поражением системы микроциркуляции в виде изолированных вне– и внутрисосудистых расстройств, и комбинированных изменений. Внесосудистые изменения касаются регуляции тонуса периферических сосудов, среди внутрисосудистых изменений основное место занимают нарушения реологического состояния крови, нарушения транскапиллярного и трансмембранного обмена [4].
Накапливающийся эндотоксин (понятие «эндотоксин» указывает на то, что токсин является частью клетки, а не секретируемым во внешнюю среду веществом) – мощный стимулятор синтеза цитокинов, особенно фактора некроза опухоли (ФНО) и интерлейкинов (ИЛ), которые усиливают реакцию на эндотоксин, активируя нейтрофилы, эндотелиальные клетки, тромбоциты и вызывая выброс других медиаторов: фактора активации тромбоцитов, компонентов комплемента, кининов, гистамина, эндорфинов. Эти вещества действуют на сердечно–сосудистую систему: снижаются общее периферическое сосудистое сопротивление и артериальное давление, возрастает сердечный выброс. Под влиянием бактериальных эндотоксинов происходит активация внутренних механизмов свертывания и системы фибринолиза, что ведет к отложению фибрина в микроциркуляторном русле, нарушению кровотока и усилению ишемии тканей. В результате свертывания крови возникают тромбозы и эмболии мелких сосудов. Липид A, входящий в состав липополисахаридов, обусловливает лихорадку, ДВС–синдром и шок. Участвующие в этом процессе вырабатываемые макрофагами ИЛ–1 и ФНО–a увеличивают сосудистую проницаемость, изменяют свойства эндотелия и вызывают гипертермию, воздействуя на терморегуляторный центр гипоталамуса [4]. При этом современные методы лечения, направленные на нейтрализацию эффектов эндотоксина (использование антител к липиду A и ФНО–a, блокатора рецепторов ИЛ–1), мало эффективны [5]. В этих условиях важную роль в комплексном лечении больных приобретает энтеросорбция [1,6,7].
Энтеросорбция – метод лечения различных заболеваний, основанный на способности энтеросорбентов связывать и выводить из организма различные экзогенные вещества, микроорганизмы и их токсины, эндогенные промежуточные и конечные продукты обмена, способные накапливаться или проникать в полость желудочно–кишечного тракта (ЖКТ) в ходе течения различных заболеваний. Энтеросорбция входит в группу средств эфферентной терапии (от латинского efferens – выводить), то есть группы лечебных мероприятий, целью которых является прекращение действия токсинов различного происхождения и их элиминация из организма. Помимо энтеросорбции, в эту группу входят гемодиализ, перитонеальный диализ, плазмаферез, гемосорбция и некоторые другие.
Сорбенты – это вещества, обладающие высокой сорбционной емкостью, не разрушающиеся в ЖКТ и способные связывать экзо– и эндогенные вещества (микроорганизмы и их токсины, яды, излишек продуктов обмена и другие вредные для организма субстанции) путем ад– и абсорбции, ионообмена или комплексообразования. История применения энтеросорбентов уходит в глубокую древность: еще врачеватели Древнего Египта, Индии, Греции использовали древесный уголь, глину, растертые туфы, пережженный рог для лечения отравлений, дизентерии, желтух и других заболеваний. Березовый или костный уголь с этой целью использовали лекари Древней Руси. Как полагают, Авиценна впервые предложил методы энтеросорбции с профилактической целью: в своем Каноне врачебной науки, говоря об искусстве сохранения здоровья, он из семи постулатов этого искусства на третье место ставил методы очистки организма от излишков. В XVIII веке были описаны сорбционные свойства углей, а в России преемник М.В. Ломоносова Т.Е. Ловиц (1757–1804) в 1785 г., изучая химические свойства древесного угля, обосновал применение метода энтеросорбции.
С появлением антибиотиков интерес к препаратам активированного угля угас. К тому же в конце 60– начале 70–х годов XX века были внедрены методы прямой очистки крови с помощью аппаратов для гемодиализа и плазмафереза. Но в последующем в связи с появлением большого числа публикаций (в том числе спекуляций) о необходимости у большого числа больных и даже практически здоровых людей периодического очищения организма от «шлаков» значимость энтеросорбции в эфферентной терапии вновь возросла. В конце 70–х годов ХХ века появились сорбенты нового поколения с высокой и селективной сорбционной емкостью для метаболитов и токсичных веществ. Этому способствовала авария на Чернобыльской АЭС, когда возникла острая необходимость выведения из организма пораженных людей радионуклидов. Сегодня растет интерес к энтеросорбентам в связи с ухудшающимся состоянием окружающей среды, особенно в крупных городах, в которых вредные факторы окружающей среды вышли за пределы допустимого, а пищевые продукты не отвечают нормативам [8,9]. Потребность в энтеросорбции и гемосорбентах многократно возрастают при стихийных бедствиях, авариях на промышленных объектах, в период проведения спасательных и аварийно–восстановительных работ [10]. В настоящее время повышается значение энтеросорбции в диетологии и диетотерапии [11].
С учетом механизма действия энтеросорбентов к ним предъявляются определенные требования: они не должны обладать токсическими свойствами и вызывать дисбактериоз; должны быть нетравматичными для слизистой оболочки, хорошо эвакуироваться из кишечника, иметь хорошие сорбционные свойства и удобную лекарственную форму.
Пероральный путь введения энтеросорбентов наиболее эффективен, так как процесс сорбции начинается в желудке и завершается в тонкой кишке. Если больные не способны самостоятельно принимать препарат, при стенозе пищевода или пилорического отдела желудка, при нарушении эвакуации сорбента из кишечника из–за динамической или механической непроходимости, энтеросорбент вводят через зонд. В этих случаях достаточна экспозиция до 30 мин, после чего сорбент может быть выведен и введена новая порция препарата. При зондовом введении происходят два процесса – сорбция и кишечный лаваж. По ограниченным показаниям энтеросорбенты вводят с помощью клизм в толстую кишку.
Используемые в настоящее время энтеросорбенты классифицируют следующим образом:
• углеродные адсорбенты на основе активированного угля (карболен, карбоктин, гастросорб), гранулированных углей (марки СКН, СКТ–6А, СУГС, СКАН и др.) и углеволокнистых материалов (ваулен, актилен, «Днепр»);
• ионообменные материалы или смолы (кайексилит, холестирамин);
• энтеросорбенты на основе лигнина (полифепан, лигносорб);
• производные поливинилпирролидона (Энтеродез®, энтеросорб);
• другие (белая глина, алюминия гидроокись, альмагель, гастал, сукральфат, силикагели, цеолиты);
• природные пищевые волокна: отруби злаковых, целлюлоза, альгинаты (Детоксал), пектины (Полисорбовит–50, Полисорбовит–95), хитозан.
Наиболее часто применяют углеродные сорбенты и энтеросорбенты на основе поливинилпирролидона.
В группу «другие» включены сорбенты, применяемые при заболеваниях желудочно–кишечного тракта, эффекты которых обусловлены их вязкостью, а не связывающей способностью.
В практике инфекциониста наиболее часто энтеросорбцию используют при острых кишечных инфекциях (ОКИ), которые в структуре инфекционной заболеваемости населения занимают второе место после острых респираторно–вирусных инфекций [12]. Неполноценное питание, постоянные стрессы, загрязненная вода и некоторые другие факторы приводят к тому, что с каждым годом увеличивается число больных, страдающих заболеваниями желудочно–кишечного тракта. Среди острых форм доминируют инфекционные диареи, составляя от 1,2 до 1,9 случаев заболевания на 1 человека в год, среди детей раннего возраста – 2,46 случаев заболевания на 1 ребенка в возрасте до 3 лет в год, среди детей до 3 лет, посещающих детские дошкольные учреждения – 5 случаев на 1 ребенка в год.
Чаще всего возбудителями диарейных заболеваний являются бактерии родов Salmonella, Shigella, ротавирусы, энтерогеморрагические кишечные палочки, Cyclospora, Cryptosporidium, Giardia и Campylobacter jejuni, Clostridium difficile [13].
В Африке диарейные болезни входят в 5 основных причин смерти (ВИЧ/СПИД – 20,6%, пневмония – 10,3%, малярия – 9,1%, диарейные болезни – 7,3%, перинатальные причины – 5,9%). В мире они занимают 7–е место (после ишемической болезни сердца, цереброваскулярных болезней, пневмонии, ВИЧ/СПИД, хронической обструктивной болезни легких). В США ежегодно с ОКИ госпитализируют около 300 тыс. больных, из которых примерно 5 тыс. погибают. В России ежегодно регистрируется около 700 тыс. больных ОКИ. По данным ВОЗ (2000), в мире от диарейных болезней на начало XXI века в год умерло от диарейных заболеваний 2,2 млн. людей, из них 1,7 млн. – дети в возрасте до 5 лет.
ОКИ характеризуются отсутствием сезонности и возрастной избирательности заболеваемости, развитием нестойкого, кратковременного видоспецифического иммунитета, а это определяет повторное развитие инфекционного процесса, вызванного другим возбудителем в течение ограниченного времени. К тому же на современном этапе ОКИ характеризуются утяжелением клинического течения отдельных нозологических форм, развитием резистентности возбудителей к традиционно применяемым этиотропным препаратам в связи с широким и нередко бесконтрольным их применением. В этой связи закономерно появились работы, в которых обосновывается целесообразность отказа в ряде случаев от традиционно применяемым антибактериальных средств при лечении больных и при необходимости усиления патогенетической терапии. С этой точки зрения несомненный интерес представляют энтеросорбенты, которые, как показано многочисленными клиническими наблюдениями, оказывают дезинтоксикационный эффект и способствуют сокращению продолжительности диареи [Беляков Н.А., 2000]. Энтеросорбция при этих заболеваниях является этиологическим и патогенетическим способом терапии. Объясняется это тем, что сорбенты поглощают из многокомпонентных растворов эндо– и экзотоксины, а вещества с макро– и мезопорами, кроме того, могут фиксировать на своей поверхности возбудителей бактериальной и вирусной природы, т.е. оказывая этиотропный эффект. В то же время, не изменяя практически состав нормальной кишечной микрофлоры, энтеросорбенты связывают токсические продукты, образующиеся в норме в кишечнике [5,6,14,15]. Но патогенетически наиболее существенен детоксикационный эффект энтеросорбции, связанный с поглощением токсических продуктов, не только образующихся в кишечнике, но и секретируемых в кишечник. Определенное значение имеет модификация сорбентами состава химуса. Достаточно хорошо документированные эффекты энтеросорбционной терапии можно рассмотреть на примере препарата с многолетней историей эффективного применения – Энтеродеза®.
Назначение Энтеродеза® при острых кишечных инфекциях способствует не только ускорению выздоровления пациента, но может решать несколько различных задач, о которых шла речь выше:
• связывание и выведение экзо– и эндотоксинов возбудителей кишечной инфекции, уменьшение эндоксикоза, вызванного патологическим процессом в кишечнике при бактериальных и вирусных заболеваниях [16,17] и при пищевых токсикоинфекциях [18,19];
• усиление эффектов патогенетической [20] и этиотропной терапии у детей [21] и взрослых [22];
• Энтеродез® может выступать как компонент микробиоценоз–сберегающей терапии [23], в том числе при сочетанном назначении с пробиотками – пробифором или бифидумбактерином [24] или кипфероном, особенно при вирусных диареях у детей [25];
Энтеросорбция применяется изолированно или в комбинации с плазмаферезом для разрешения интоксикации различной природы не только при ОКИ, но и многих других болезнях инфекционной этиологии, в том числе при ОРВИ, вирусном гепатите, туберкулезе [26].
Терапевты с успехом применяют энтеросорбцию (в том числе Энтеродез®) при панкреатите, нарушениях жирового обмена, для снижения в крови уровня холестерина, профилактики и лечения атеросклероза, ишемической болезни сердца, при токсикозе и холестатическом гепатозе у беременных [27], ожоговой болезни [28–30], неспецифическом язвенном колите, а также во время беременности [31].
Широкий круг «инфекционных проблем» в хирургической практике также может быть решен с применением энтеросорбционных технологий:
• в послеоперационном периоде у больных гнойным разлитым перитонитом путем проведения кишечного лаважа глюкозо–солевым раствором с добавлением Энтеродеза® в дозе 1 г/кг в сутки [32];
• при кишечной непроходимости [33];
• проведение энтерального питания в раннем послеоперационном периоде с предварительной декомпрессией кишечника и проведением кишечного лаважа глюкозо–электролитной смесью с добавлением Энтеродеза® (в дозе 50–70 г/сут), глутамина (20–30 г/сут) и 2% раствора пектина. Восстановление всасывательной способности тонкой кишки отмечали через 10–12 ч [34].
Кишечник, легкие, кожные покровы – это и резервные и вспомогательные системы детоксикации, имеющие важнейшее значение наряду с почками и печенью. При хронической почечной недостаточности, по имеющимся данным, эффективно применение энтеросорбентов для уменьшения азотемии. Применяется Энтеродез®, в том числе в связи с туберкулезным поражением почек [35,36].
Еще одним немаловажным направлением профилактики и разрешения патологических процессов является применение энтеросорбентов при иммунопатологических состояниях, особенно связанных с поступлением аллергенов через желудочно–кишечный тракт. Включение Энтеродеза® в состав комплексной терапии псориаза [37] и атопического дерматита у детей [38] позволяет быстро купировать острые проявления заболевания, уменьшить потребность в стационарном лечении.
Таким образом, энтеросорбенты – препараты медицинского назначения, обладающие высокой сорбционной емкостью, не разрушающиеся в ЖКТ и способные связывать экзо– и эндогенные вещества, входящие в состав химуса и выделяющиеся в полость ЖКТ через его стенки, путем ад– и абсорбции, ионообмена или комплексообразования. Сегодня энтеросорбция – самостоятельная область медицины, которая постоянно развивается, предлагая новые, все более эффективные препараты, которые выполняют роль естественных энтеросорбентов и выводят из организма многие ненужные и вредные вещества.
Энтеросорбция оказалась эффективным дополнением традиционного лечения таких заболеваний, как острые кишечные инфекции, вирусный гепатит, острый панкреатит, ишемическая болезнь сердца, гиперлипидемия, атеросклероз, сахарный диабет, бронхиальная астма, расстройства иммунной системы, хронические колиты, острая и хроническая почечная недостаточность, пищевые отравления, острый лейкоз и другие. К достоинствам метода следует отнести его высокую эффективность и низкую стоимость.
Литература
1. Учайкин В.Ф. Энтеросорбция эффективный метод этиопатогенетической терапии острых кишечных инфекций / В.Ф. Учайкин, А.А. Новокшонов, Н.В. Соколова // Дет. инфекции. – 2005. – № 3. – С. 39–43.
2. Покровский В.И., Поздеев О. (ред.). Медицинская микробиология. М.: ГОЭТАР «МЕДИЦИНА», 1998. – 1155 с.
3. Симбирцев С.А., Беляков Н.А. Патофизиологические аспекты эндогенной интоксикации / В кн. «Эндогенные интоксикации». Cб. тезисов международного симпозиума, СПб, 1994. – С. 5–9.
4. Зайчик А.Ш., Чурилов Л.П. Основы патохимии. – СПб.: «ЭЛИБИ–СПб», 2000. – 687 с.
5. Костюченко А.Л. Активная детоксикация // Мир медицины. СПб., 2000. – № 9–10.
6. Щербаков П.Л., Петухов В.А. Сравнительная эффективность энтеросорбентов при диарее у детей // Вопросы современной педиатрии. – 2005. – № 4. – С. 85–89.
7. Сухов Ю.А., Гебеш В.В. Влияние энтеросорбции на уровень провоспалительных цитокинов при кишечной инфекции и кори // Клиническая иммунология. – 2007. – № 1 (6). – С. 76–78.
8. Белозеров Е.С., Джасыбаева Т.С. Социально–экологические аспекты здоровья человека. Алматы. Изд–во «Галым». – 1993. – 221 с.
9. Серебрянский Е.П. Разработка спектрометрических методов определения химических элементов в окружающей среде и биосредах человека для гигиенических исследований // Автореф … дисс. канд. мед. наук. – М., 2003. 24 с.
10. Безопасность в чрезвычайных ситуациях. Лечебно–эвакуационное обеспечение населения. ГОСТ Р 22.3.02–94.М., 1994.
11. http://vostokpharm.ru/absorb2.htm, 2009.
12. Онищенко Г.Г. О профилактике острых кишечных инфекций. Постановление Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека № 21 от 19.03.2010.
13. Ивашкин В.Т., Шептулин А.А. Синдром диареи. – М.: ГЭОТАР МЕДИЦИНА, 2000. – 135 с.
14. Беляков Н.А., Соломенников А.В. Энтеросорбция – механизм лечебного действия //Эфферентная терапия, т. 3, № 2, 1997.
15. Беляков Н.А. Эндогенные интоксикации и лимфатическая система // Эфферентная терапия, т. 4, № 2, 1998.
16. Лобан К.М., Митерев Ю.Г., Жеребцов Л.А. и др. Эффективность препарата «Энтеродез®» при острых кишечных инфекциях // Гематология и транфузиология. – 1983. – №7. – С. 33–39.
17. Суздалева В.В., Недошивина Р.В. Макарова Н.Л. Эффективность препаратов поливинилпирролидона при токсемии // Патологическая физиология и экспериментальная терапия. – 1978. – №5. – С. 667–684.
18. Гульбаданова Н.М., Васильев П.С., Детоксицирующий эффект поливинилпирролидона в терапии острых пищевых инфекций // Проблемы гематологии и переливания крови. – 1966. – №11(7). – С. 19–23.
19. Махнев В.Г. Первая помощь при острых пищевых отравлениях // Consilium Medicum. Популярная медицина. – 2003. – Том №3. – №4.
20. Авдошенкова О. Г., Иванов Р. В., Максвитис Р. Й. Применение препарата Энтеродез® в терапии интоксикационного синдрома инфекционной этиологии // Главный врач. – 2010. – №2 (21). – С. 50–53.
21. Новокшенов А.А. Этиопатогенетическая терапия острых кишечных инфекций у детей // Журн. Наука. 1999. – № 46. – С. 52.
22. Новокшонов А.А. Острые кишечные инфекции – основные направления и принципы этиотропной и патогенетической терапии // Медицинский научный и учебно–методический журнал/ Лекции. – 2007 – http://www.medic–21vek.ru/lekc/detail.php?ID=2611.
23. Учайкин В.Ф., Новокшонов А.А., Соколова Н.В., Сахарова А.А., Бережкова Т.В., Ларина Т.С. Место и значение энтеросорбции в этиопатогенетической терапии острых кишечных инфекций у детей // Педиатрия. – 2007. – № 2. – С. 44–50.
24. Учайкин В. Новое в лечении острых кишечных инфекций у детей // http://medinfa.ru/article/25/118640/.
25. Корочкина О.В., Собчак Д.М. Опыт применения Кипферона® в клинике инфекционных болезней // Трудный пациент. – 2009. – №4–5. – С. 32–35.
26. Генералова Р.В., Невенгловский И.Е., Стрельникова В.А. Дезинтоксикационная терапия с использованием Энтеродеза® пациентов с туберкулезом мочевыделительной системы // Проблемы туберкулеза. – 1990 – №5. – С. 68–70.
27. Линева О.И., Романова Е.Ю. Холестатический гепатоз беременных: патогенетические подходы к выбору методов лечения // Практическая медицина. – 2009 – №2. Гинекология. – http://mfvt.ru/xolestaticheskij–gepatoz–beremennyx–patogeneticheskie–podxody–k–vyboru–metodov–lecheniya/.
28. Шиманко И.И., Суздалева В.В., Галкина Г.С. и др. Применение Энтеродеза® и энтеросорба у больных с различной патологией, сопровождающейся тяжелым эндотоксикозом. // Гематология и трансфузиология. – 1984. – №11. – С. 31–35.
29. Суздалева В.В. Особый статус проблемы детоксикации // Гематология и транфузиология. – 1987. – Т. 32. – №7. – С. 3–5.
30. Гюльдабамова Н.М., Васильев П.С., Суздалеева В.В. О механизме детоксикационного действия поливинилпиролидона при ожоговой болезни и пищевой токсикоинфекции // Проблемы гематологии и переливания крови, – 1962 – №7. – С. 19–23.
31. Шехтман М.М., Козинова О.А. Неспецифический язвенный колит и беременность // Consilium Medicum. Гинекология. – 2008. – Том 10. – №1.
32. Шестопалов А.Е., Зингеренко В.Б. Растворы аминокислот для парентерального питания в интенсивной терапии критических состояний // Трудный пациент. – 2005. – №10–11.
33. Щтрапов А.А., Рухлиада В.В. Энтеральная детоксикация пациентов с острой кишечной непроходимостью // Вестник клинической иммунологии. – 1986. – 136(5). – С. 32–35.
34. Арутюнов Г.П., Бугров А.В., Борисов А.Ю. и др. Энтеральное питание в лечении хирургических и терапевтических больных / Методические рекомендации. – М., 2006. – 48 с.
35. Козлов С.В. Микрохолецистомия с энтеросорбцией и энтеральным питанием в лечении острого холецистита у больных с высокой степенью операционного риска // Дисс. … канд. мед. наук. – Ярославль, 1999.
36. Рутгайзер Я. Лечение хронической почечной недостаточности // http://medpositive.ru/?category=urologiya&altname=Lechenie_khronicheskoy_pochechnoy_nedostatochnosti.
37. Бишарова А. С. Псориаз у детей // Лечащий врач. – 2006. – №9.
38. Смирнова Г.И. Лечение атопического дерматита у детей // Фармацевтический вестник http://www.medlinks.ru/article.php?sid=7322.
39. Бурмистров В.А. Опыт применения новых серебросодержащих препаратов ЗАО «Вектор–Бест» // «Новости «Вектор–Бест». – Июнь 2001. – № 2(20).
40. Лучшев В., Шахмарданов М. Актуальные вопросы терапии пищевых токсикоинфекций // http://03portal.kz/mv/9/index.php?option=com_content&task=view&id=7530&Itemid=112.
Захаренко С.М.
РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: